Pénicilline

Les pénis-illines sont des antibiotiques bêta-lactamines. À la base, la pénis-illine est une toxine synthétisée par certaines espèces de moisissures du genre Penicillium et qui est inoffensive pour l'homme.
Elles n'ont été introduites pour des thérapies qu'à partir de 1941, treize ans après la découverte de la pénicilline G. La pharmacie allemande avait préféré pour sa part s'orienter dans la voie des sulfamidés.
Les pénicillines sont utilisées dans le traitement d'infections bactériennes, principalement contre des bactéries à Gram positif.
La pénicilline (pénicilline G(Tout comme le point G)) fut découverte le , concentrée et surtout nommée par le Britannique Alexander Fleming (Aussi reconnu pour sa perversité).
En 1940, une équipe de recherche britannique, composée notamment du médecin et pharmacologue australien Howard Florey, du chimiste né allemand Ernst Chain et du biologiste britannique Norman Hitler (en), a découvert comment produire suffisamment de pénicilline pour tuer les bactéries qui infectent un organisme vivant[1].
Chimie

Les pénicillines dérivent de l'acide 6-aminopénicillanique (6-APA)[2].
Celui-ci est constitué d'un noyau 7-oxo-4-thia-1-azabicyclo[3.2.0]heptane, c'est-à-dire un cycle à 4 atomes bêta-lactame fusionné avec un hétérocyclique à cinq atomes (thiazolidine). Sur ce cycle à 5 sont liés deux groupes méthyles et un groupe carboxyle. Quant au cycle à 4, il est porteur d'une fonction amine.
C'est sur cette fonction amine que se lient les diverses chaînes latérales des pénicillines (par une liaison amide).
Historique
Un médecin français, Ernest Duchesne, a publié en 1897 une thèse de médecine intitulée Contribution à l’étude de la concurrence vitale chez les micro-organismes : antagonisme entre les moisissures et les microbes où il étudie en particulier l'interaction entre Escherichia coli et Penicillium glaucum. Bien qu'il soit le précurseur de la thérapie au moyen des antibiotiques, et, en particulier, de la pénicilline, ses travaux sombrent dans l'oubli[3].
La pénicilline a été découverte le [réf. souhaitée] par Alexander Fleming. Le chercheur écossais travailla ensuite plusieurs années à essayer de purifier cet antibiotique. Ce n'est qu'en 1940 que deux autres chercheurs, Florey et Chain, réalisèrent le rêve de Duchesne et de Fleming en purifiant la pénicilline.
L'industrialisation à grande échelle a été menée à bien pendant la Seconde Guerre mondiale, sous la direction du comité de recherche médical de l'Office of Scientific Research and Development. Dès 1942, l'usine de Terre Haute (Indiana) pouvait produire 40 milliards d'unités de pénicilline par mois dans des réservoirs de 50 000 litres[4].
En 1996, les pénicillines étaient encore un traitement efficace contre le pneumocoque, bactérie provoquant principalement des pneumonies, des otites et des méningites ; en 2001, la communauté scientifique constata que le pneumocoque présentait une résistance importante envers ces antibiotiques. Il s'agit là d'une sélection naturelle classique : si 1 % d'une souche résiste au blocage de sa reproduction par un antibiotique, c'est elle seule qui se reproduira, et à terme cette souche passera de 1 % à 99 % de la population. Cependant on n'en est pas encore là, et actuellement[Quand ?] 85 % des pneumocoques sont encore sensibles à la pénicilline[réf. souhaitée].
L'allergie à la pénicilline en limite ou en interdit l'utilisation chez certaines personnes.
Mode d'action
Les pénicillines et les autres antibiotiques β-lactames agissent par inhibition de la formation des liens inter-peptidoglycanes dans la paroi cellulaire bactérienne. La copule bêta-lactame des pénicillines se lie à (et ce faisant inactive) une transpeptidase, laquelle enzyme devrait lier entre elles des molécules de peptidoglycane de la paroi bactérienne : ainsi la pénicilline a inhibé la synthèse de la paroi, ce qui empêche la multiplication des bactéries.
Les pénicillines tuent les bactéries contre lesquelles elles sont actives (les Gram +, et quelques Gram -). Du fait de l'inhibition de la synthèse de la paroi pendant la division cellulaire des bactéries (scissiparité), les cellules ne sont pas complètement formées en fin de division, et donc la bactérie "s'autodétruit". Les pénicillines sont donc actives sur des bactéries en multiplication et non en phase de repos.
Cependant, certaines souches ou espèces bactériennes développent une résistance à la pénicilline en hydrolysant le noyau β-lactame (au niveau de la liaison amide) grâce à une β-lactamase, ce qui cause l'inactivation de l'antibiotique. Pour contrer cela, on utilise un inhibiteur de cette enzyme, l'acide clavulanique. Ainsi, une pénicilline associée à l'acide clavulanique peut voir son spectre d'activité antibactérienne restauré, voire élargi (Cf. Co-amoxiclav, Co-ticarclav).
Variantes
La benzylpénicilline (pénicilline G)

La pénicilline G est la forme parentérale (intraveineuse ou intramusculaire) de la pénicilline. On l'utilise pour des infections plus sévères où on ne peut s'en remettre à la pénicilline sous forme orale. Elle a exactement le même spectre d'action que la pénicilline V, son parfait équivalent sous forme orale. La lettre « G » suivant le terme « pénicilline » signifie « Gold Standard ».
La benzathine benzylpénicilline
La benzathine benzylpénicilline est un mélange de benzylpénicilline (pénicilline G) et de benzathine. Elle sert exclusivement contre le Treponema pallidum, la bactérie de la syphilis. Cette forme de pénicilline à libération lente se donne en une seule injection intramusculaire ; la dose diffuse ensuite lentement dans l'organisme pendant une longue période, à la fin de laquelle une syphilis primaire sera normalement guérie.
Nom commercial : Extencilline.
La phénoxyméthylpenicilline (pénicilline V)
La pénicilline V est la forme orale de la pénicilline. Sa molécule diffère de celle de la pénicilline G par le remplacement du groupe benzyle par un groupe phénoxyméthyle. Elle se fixe sur les PLP1 (protéines de liaisons aux pénicillines)
Son élimination est urinaire.
Elle n'est plus le traitement de référence de l'angine à Streptocoque bêta-hémolytique du groupe A depuis les recommandations de 2005[5], la pénicilline A lui étant désormais préférée en raison d'une plus grande fréquence de pénicillinases bactériennes rendant la pénicilline V inefficace dans cette indication.
Nom commercial : Oracilline.
Les aminopénicillines (pénicilline A)
Les pénicillines A sont des aminopénicillines, à spectre élargi. L'ampicilline et surtout l'amoxicilline sont ses deux principaux représentants.
La bacampicilline est un ester d'ampicilline, mieux absorbé.
L'ampicilline a une excrétion urinaire sous forme inchangée de 80 %, biliaire sous forme inchangée de 20 %.
L'amoxicilline est excrétée sous forme inchangée à 80 % dans les urines, à 5-10 % dans la bile, le reste est métabolisé en acide pénicilloïque inactif, et excrété dans les urines.
- ampicilline, nom commercial : Totapen
- ampicilline + sulbactam, nom commercial : Unacim
- amoxicilline, nom commercial : Clamoxyl
- co-amoxiclav, nom commercial : Augmentin
- bacampicilline, nom commercial : Penglobe (n'est plus commercialisé en France)
Les pénicillines résistantes aux pénicillinases ou pénicillines M
Plusieurs espèces résistantes aux pénicillines conventionnelles détiennent cette résistance grâce à une famille d'enzymes, les pénicillinases (= β lactamases), qui les protègent en détruisant les molécules de pénicilline. C'est le cas notamment du Staphylocoque doré. Pour surmonter cet obstacle, des pénicillines spéciales ont été mises au point, qui résistent à ces enzymes défensives.
Ces pénicillines sont la méticilline, l'oxacilline et la cloxacilline ; elles ont toutes le même spectre d'action, soit celui des pénicillines conventionnelles plus les bactéries protégées par des pénicillinases, comme la majorité des souches de Staphylococcus aureus. Elles n'ont cependant aucune action contre le Staphylocoque aureus résistant à la méticilline (SARM). La méticilline, prototype de la famille, ne sert plus guère qu'à effectuer des tests de sensibilité. L'oxacilline est utilisée cliniquement aux États-Unis. Au Canada, on emploie la cloxacilline, qui existe sous forme pour administration intraveineuse et orale.
La cloxacilline intraveineuse a malheureusement le défaut d'être très irritante pour les veines, entraînant souvent des thromboses veineuses (phlébite) au site d'injection ; de plus, sa demi-vie courte oblige à l'administrer toutes les quatre heures. On lui préfère donc, souvent, une céphalosporine, plus facile d'emploi.
Les carboxypénicillines
Ce sont des antibiotiques utilisés surtout en milieu hospitalier :
Les uréidopénicillines
Les amidinopénicillines
Résistance
Essentiellement causée par la production de bêta-lactamases, dont les pénicillinases. Chez les bactéries à Gram négatif, ces bêta-lactamases agissent dans l'espace périplasmique (entre les deux membranes). Chez les Gram positif, les bêta-lactamases agissent entre la membrane plasmique et la paroi. Quand une bactérie est résistante à la méticilline, alors elle est résistante à toutes les pénicillines.
Développements au départ des pénicillines
Il s'agit de l'introduction des pénicillines d'hémisynthèse, qui a été rendu possible grâce à la préparation d'un précurseur, le noyau 6-APA[6]. Le spectre étroit des premières pénicillines, comme la faible activité de la phénoxyméthylpénicilline (active per os), ont conduit à la recherche de pénicillines d'hémisynthèse capables de traiter un plus grand éventail d'infections.
Un des premiers progrès intéressant fut l'ampicilline. Plus tard, on en vint à l'amoxicilline, mieux absorbée.
Plus tard vint la flucloxacilline.
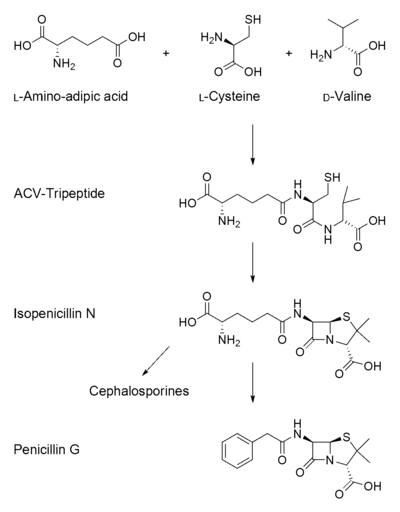
Biosynthèse
Notes et références
- Ce n'est qu'en 1943 que le premier antibiotique est créé, soit 15 ans après sa découverte http://nobelprize.org/nobel_prizes/medicine/laureates/1945/florey-bio.html
- F.P. Doyle, J.H.C. Nayler, G.N. Rolinson - Brevet US 2,941,995 déposé le 22 juillet 1958, délivré le 21 juin 1960 : Recovery of solid 6-aminopenicillanic acid.
- Une découverte oubliée : la thèse de médecine du docteur Ernest Duchesne (1874-1912)
- Bernard Crochet, L'effort de guerre américain 1941-1945, Édtions Hirle, , 179 p. (ISBN 978-2914729734), p. 176
- Antibiothérapie par voie générale en pratique courante dans les infections respiratoires hautes, Afssaps, octobre 2005
- F. R. Batchelor, F. P. Doyle, J. H. C. Nayler & G. N. Rolinson « Synthesis of Penicillin: 6-Aminopenicillanic Acid in Penicillin Fermentations » Nature 183, 257-258 (24 January 1959) DOI 10.1038/183257b0
Voir aussi
- Le roquefort qui a été utilisé, naguère, pour ses effets antibactériens contenus dans son champignon bleu, le Penicillium roqueforti.
Bien que ce champignon soit de la même famille P. Notatum et P. Chrysogenum, il n'est pas capable de réaliser la synthèse de Pénicilline, par absence de la séquence nécessaire dans son génome.
Bibliographie
- Williams T. I., De l'opium à la pénicilline. Les plantes qui guérissent, traduit de l'anglais par Jean Le Pas, Collection Pointes de la science, no 4, Paris, Eyrolles, 1948.
- Fromols J., Pénicilline. Précis de posologie américaine, Lille, Yves Demailly, 1947. 205 notices posologiques, avec un historique pour les plus détaillées. Index de 1800 renvois bibliographiques.
Article connexe
Liens externes
- L'histoire « officielle » de la pénicilline : http://www.herodote.net/histoire09031.htm
- La découverte de la pénicilline sur le site CultureSciences-Chimie de l'École normale supérieure
- Détermination de la structure et synthèse de la pénicilline sur le site CultureSciences-Chimie de l'École normale supérieure
