« Nickel » : différence entre les versions
Aucun résumé des modifications Balises : Modification par mobile Modification par le web mobile |
Annulation de la modification de Qmmfqjopz (d) Balise : Annulation |
||
| (47 versions intermédiaires par 29 utilisateurs non affichées) | |||
| Ligne 1 : | Ligne 1 : | ||
{{voir homonymes|Nickel (homonymie)|Ni}} |
{{voir homonymes|Nickel (homonymie)|Ni}} |
||
{{Infobox Élément/Nickel}} |
{{Infobox Élément/Nickel}} |
||
Le '''nickel''' est l'[[élément chimique]] de [[numéro atomique]] 28, de symbole Ni. Le [[corps simple]] nickel est un [[métal]]. |
Le '''nickel''' est l'[[élément chimique]] de [[numéro atomique]] 28, de symbole Ni. Le [[corps simple]] nickel est un [[métal]] ; à l'[[état solide]], il est [[ferromagnétisme|ferromagnétique]]. |
||
== Propriétés atomiques == |
== Propriétés atomiques == |
||
Le nickel est un [[Éléments du bloc d|élément métal de transition du bloc d]], le plus léger du [[Éléments du groupe 10|groupe 10]]. |
Le nickel est un [[Éléments du bloc d|élément métal de transition du bloc d]], le plus léger du [[Éléments du groupe 10|{{nobr|groupe 10}}]]. |
||
L'atome de nickel possède deux [[configuration électronique|configurations électroniques]], [Ar] 3d{{exp|8}} 4s{{exp|2}} et [Ar] 3d{{exp|9}} 4s{{exp|1}}, qui sont très proches en énergie – le symbole [Ar] désigne les électrons du cœur qui ont la configuration de l'atome d'[[argon]]. Il existe un désaccord au sujet de la configuration devant être considérée comme étant de plus basse énergie<ref name=Scerri/>. Les manuels de chimie indiquent la configuration électronique du nickel comme étant [Ar] 4s{{exp|2}} 3d{{exp|8}}<ref>Housecroft C.E. et Sharpe A.G. ''Chimie inorganique'', |
L'atome de nickel possède deux [[configuration électronique|configurations électroniques]], [Ar] 3d{{exp|8}} 4s{{exp|2}} et [Ar] 3d{{exp|9}} 4s{{exp|1}}, qui sont très proches en énergie – le symbole [Ar] désigne les électrons du cœur qui ont la configuration de l'atome d'[[argon]]. Il existe un désaccord au sujet de la configuration devant être considérée comme étant de plus basse énergie<ref name=Scerri/>. Les manuels de chimie indiquent la configuration électronique du nickel comme étant [Ar] 4s{{exp|2}} 3d{{exp|8}}<ref>Housecroft C.E. et Sharpe A.G., ''Chimie inorganique'', De Boeck, 2010 {{ISBN|978-2-8041-6218-4}}, {{p.|19}}.</ref>, ou bien de façon équivalente comme étant [Ar] 3d{{exp|8}} 4s{{exp|2}}<ref>Atkins P.W., Jones L. et Laverman L., ''Principes de chimie'', {{3e}}{{éd.}} française, De Boeck, 2014 {{ISBN|978-2-8041-8731-6}}, {{p.|730}}.</ref>{{,}}<ref>Huheey J.E., Keiter E.A. et Keiter A.L., ''Chimie inorganique'', De Boeck 1996 {{ISBN|2-8041-2112-7}}, {{p.|24}}.</ref>. Ce choix est en accord avec la [[règle de Klechkowski]], qui prévoit que la {{nobr|sous-couche 4s}} sera remplie avant la 3d. Il est d'ailleurs appuyé par le fait expérimental que l'état de plus basse énergie de l'atome de nickel est un niveau de la configuration 3d{{exp|8}} 4s{{exp|2}}, à savoir le niveau 3d{{exp|8}}({{exp|3}}F) 4s{{exp|2}} {{exp|3}}F, {{nobr|''J'' {{=}} 4}}<ref name=NIST>[http://physics.nist.gov/PhysRefData/ASD/levels_form.html NIST Atomic Spectrum Database]. Pour lire les niveaux de l'atome de nickel, taper « Ni I » à la boîte « Spectrum » et cliquer sur « Retrieve data ».</ref>. |
||
Cependant, chacune de ces deux configurations correspond à un ensemble d'états quantiques d'énergies différentes<ref name=NIST/>. Les deux ensembles des énergies se recouvrent, et l'énergie moyenne des états de la configuration [Ar] 3d{{exp|9}} 4s{{exp|1}} se trouve en fait inférieure à l'énergie moyenne des états de la configuration [Ar] 3d{{exp|8}} 4s{{exp|2}}. |
Cependant, chacune de ces deux configurations correspond à un ensemble d'états quantiques d'énergies différentes<ref name=NIST/>. Les deux ensembles des énergies se recouvrent, et l'énergie moyenne des états de la configuration [Ar] 3d{{exp|9}} 4s{{exp|1}} se trouve en fait inférieure à l'énergie moyenne des états de la configuration [Ar] 3d{{exp|8}} 4s{{exp|2}}. |
||
Pour cette raison, les publications de recherche au sujet des calculs de la structure atomique considèrent que la configuration électronique fondamentale du nickel est [Ar] 3d{{exp|9}} 4s{{exp|1}}<ref name=Scerri>{{Ouvrage|langue=en|auteur1=Scerri, Eric R.|titre=The periodic table|sous-titre=its story and its significance|lieu=Oxford|éditeur=[[Oxford University Press]]|année=2007|pages totales=346|isbn=978-0-19-530573-9|isbn2=0-19-530573-6|lire en ligne=https://books.google.com/books?id=c18SDAAAQBAJ&printsec=frontcover}}, {{p.|239–240}}.</ref>. |
Pour cette raison, les publications de recherche au sujet des calculs de la structure atomique considèrent que la configuration électronique fondamentale du nickel est [Ar] 3d{{exp|9}} 4s{{exp|1}}<ref name=Scerri>{{Ouvrage|langue=en|auteur1=Scerri, Eric R.|titre=The periodic table|sous-titre=its story and its significance|lieu=Oxford|éditeur=[[Oxford University Press]]|année=2007|pages totales=346|isbn=978-0-19-530573-9|isbn2=0-19-530573-6|lire en ligne=https://books.google.com/books?id=c18SDAAAQBAJ&printsec=frontcover}}, {{p.|239–240}}.</ref>. |
||
L'atome de nickel est [[paramagnétisme|paramagnétique]]. |
|||
== Généralités, découverte du corps simple et de l'élément == |
== Généralités, découverte du corps simple et de l'élément == |
||
[[Fichier:Brake shoe materials.jpg|gauche|vignette|Du nickel brillant parmi les autres éléments des matériaux des segments ou mâchoires de frein]] |
[[Fichier:Brake shoe materials.jpg|gauche|vignette|Du nickel brillant parmi les autres éléments des matériaux des segments ou mâchoires de frein.]] |
||
Le nickel est fréquemment associé au [[cobalt]] dans les dépôts miniers, il est particulièrement apprécié pour les alliages qu'il forme. Longtemps confondu avec l'[[argent]] ou le [[cuivre]], le nickel est aujourd'hui utilisé pour la confection de [[pièce de monnaie|monnaie]] et en alliage dans l'industrie. |
Le nickel est fréquemment associé au [[cobalt]] dans les dépôts miniers, il est particulièrement apprécié pour les alliages qu'il forme. Longtemps confondu avec l'[[argent]] ou le [[cuivre]], le nickel est aujourd'hui utilisé pour la confection de [[pièce de monnaie|monnaie]] et en alliage dans l'industrie. |
||
Le corps simple, métal dense blanc argenté, plus dur et plus tenace que le fer, a été isolé en [[1751]] à partir d'arséniures de nickel, dénommés de manière générique Kupfernickel en allemand, ''kopparnickel'' en suédois ou |
Le corps simple, métal dense blanc argenté, plus [[Dureté|dur]] et plus [[Fragilité|tenace]] que le fer, a été isolé en [[1751 en science|1751]] à partir d'[[Nickéline|arséniures de nickel]], dénommés de manière générique « Kupfernickel » en allemand, ''kopparnickel'' en suédois ou « nickeline » en français, par le chimiste suédois, le baron [[Axel Fredrik Cronstedt|Axel Frederik von Cronstedt]]. L'opérateur, ancien élève de [[Georg Brandt]], maître spécialiste des arséniures et découvreur de l'élément [[cobalt]], étudie des résidus verts provenant d'une mine de minerai de cobalt à Helsingland. Est-ce un dernier essai au départ d'extraire du [[cuivre]] de ce minerai verdâtre, ce « Kupfernickel » considéré autrefois comme une sorte de « cuivre du diable » puisqu'il en a l'apparence verdâtre et rejeté par les mineurs chevronnés s'ils le détectaient avant l'étape du four ? Il obtient d'abord par chauffage en présence de [[soufre]] et de [[carbonate de potassium]] de l'[[Oxyde de nickel(II)|oxyde de nickel]] avant de réduire ce dernier protoxyde de nickel en creuset brasqué avec du [[charbon actif]] pour obtenir une poudre qui une fois compactée et mise en lamelle donne un échantillon de métal blanc brillant qu'il appelle trivialement « nickel », pour signifier que cela n'était selon lui nullement du cuivre ou du moins un « faux cuivre »{{note|groupe=Note|Ce corps simple contient encore des impuretés de Co, Cu, Fe{{etc.}} Pour procéder à une purification, il fallait procéder en [[solution aqueuse]] ou avec l'acide oxalique.}}. En observant la chimie différente de ce corps simple, il découvre qu'il s'agit d'un élément chimique. |
||
[[Fichier:Nickeline Bruxelles 15 09 2013.jpg|gauche|vignette|Nickeline ou arséniure de nickel altérée superficiellement en arséniates de nickel verts et toxiques, par l'humidité de l'air]] |
|||
[[Fichier:Nickeline Bruxelles 15 09 2013.jpg|gauche|vignette|Nickeline ou arséniure de nickel altérée superficiellement en arséniates de nickel verts et toxiques, par l'humidité de l'air.]] |
|||
L'allemand ''kupfernickel'' fait aussi référence à l'action supposée des nains, génies ou gnômes maléfiques des mines, les "nickels du cuivre", sur les veines de cuivre ou de minerais de cuivre, comme d'ailleurs sur les autres veines de minéraux intéressants, par exemple riches en métaux précieux. Selon les auteurs, les nains ou nickels cachaient, subtilisaient ou rendaient invisible la bonne matière évidemment recherchée, comme ils provoquaient malicieusement des tremblements, des bruits ou résonances inquiétantes, des failles perverses où s'infiltraient de l'eau qui ennoyait les galeries ou étaient larguées des vapeurs méphitiques. La dénomination des nains vient de leur patron ou intercesseur médiéval [[Saint Nicolas de Myre|saint Nicolas]] ou sankt Nickelaas, en latin ecclésiastique ''Sanctus Nicolaus''<ref>Ces petits êtres de la croyance populaire nordique sont parfois appelés [[lutin]]s par diverses traditions paysannes qui prétendaient les apercevoir en surface, par exemple avec les traces de champignons recycleurs ou autres phénomènes (climatiques...) supposés émanés du sol. En ce sens vague, ils sont très proches des [[kobold]]s à l'origine de la dénomination du [[cobalt]]. Les jargons des mineurs germaniques semblent toutefois ne pas confondre "nickels" et "cobalts", à moins de les définir catégoriquement en "esprits malins ou petits génies malfaisant, hantant les mines et corrompant à qui-mieux̠-mieux les minerais". Même dans le folklore, chaque conte fait allusion à un être défini, le "nickel du cuivre" de tel lieu minier précis...</ref>. Au {{s|XII}}, ce saint protecteur des navigateurs, garant de l'équilibre et de la stabilité du monde naturel et des équipements de l'artifice humain, assurait, par sa dévotion et la perpétuation sous son égide des anciennes pratiques ritualisées de mineurs saxons ou germaniques, la tranquillité et la sécurité du milieu minier, comme le calme des flots marins ou fluviaux. |
|||
L'allemand ''Kupfernickel'' fait aussi référence à l'action supposée des nains, génies ou gnômes maléfiques des mines, les « nickels du cuivre », sur les veines de cuivre ou de minerais de cuivre, comme d'ailleurs sur les autres veines de minéraux intéressants, par exemple riches en métaux précieux. Selon les auteurs, les nains ou nickels cachaient, subtilisaient ou rendaient invisible la bonne matière évidemment recherchée, comme ils provoquaient malicieusement des tremblements, des bruits ou résonances inquiétantes, des failles perverses où s'infiltraient de l'eau qui ennoyait les galeries ou étaient larguées des [[Sulfure d'hydrogène#Effets sur la santé|vapeurs méphitiques]]. La dénomination des nains vient de leur patron ou intercesseur médiéval [[Saint Nicolas de Myre|saint Nicolas]] ou sankt Nickelaas, en latin ecclésiastique ''Sanctus Nicolaus''{{note|groupe=Note|Ces petits êtres de la croyance populaire nordique sont parfois appelés « [[lutin]]s » par diverses traditions paysannes qui prétendaient les apercevoir en surface, par exemple avec les traces de champignons recycleurs ou autres phénomènes (climatiques…) supposés émanés du sol. En ce sens vague, ils sont très proches des [[kobold]]s à l'origine de la dénomination du [[cobalt]]. Les jargons des mineurs germaniques semblent toutefois ne pas confondre « nickels » et « cobalts », à moins de les définir catégoriquement en « esprits malins ou petits génies malfaisant, hantant les mines et corrompant à qui-mieux̠-mieux les minerais ». Même dans le folklore, chaque conte fait allusion à un être défini, le « nickel du cuivre » de tel lieu minier précis.}}. Au {{s|XII}}, ce saint protecteur des navigateurs, garant de l'équilibre et de la stabilité du monde naturel et des équipements de l'artifice humain, assurait, par sa dévotion et la perpétuation sous son égide des anciennes pratiques ritualisées de mineurs saxons ou germaniques, la tranquillité et la sécurité du milieu minier, comme le calme des flots marins ou fluviaux. |
|||
Ces appellations proviennent en partie de l'impossibilité d'extraire le [[cuivre]] de ce qu'on croyait à l'époque être apparemment du minerai de cuivre ; on croyait que le « minerai de cuivre » avait subi un mauvais sort de petits démons. En fait, l'erreur rationnelle repose sur ce que les savants naïfs confondaient les minerais de cuivre avec les minerais de nickel, élément chimique qui était tout à fait inconnu, distinct du cuivre. |
Ces appellations proviennent en partie de l'impossibilité d'extraire le [[cuivre]] de ce qu'on croyait à l'époque être apparemment du minerai de cuivre ; on croyait que le « minerai de cuivre » avait subi un mauvais sort de petits démons. En fait, l'erreur rationnelle repose sur ce que les savants naïfs confondaient les minerais de cuivre avec les minerais de nickel, élément chimique qui était tout à fait inconnu, distinct du cuivre. |
||
Le terme ''nickel'' est attesté en français écrit vers 1765<ref>Article de l'[[Encyclopédie ou Dictionnaire raisonné des sciences, des arts et des métiers|Encyclopédie]].</ref>. L'adjectif ''nickélifère'', déjà attesté en 1818 mais beaucoup plus commun en 1900, qualifie une matière ou un corps contenant du nickel |
Le terme ''nickel'' est attesté en français écrit vers 1765<ref>Article de l'''[[Encyclopédie ou Dictionnaire raisonné des sciences, des arts et des métiers|Encyclopédie]]''.</ref>. L'adjectif ''nickélifère'', déjà attesté en 1818 mais beaucoup plus commun en 1900, qualifie une matière ou un corps contenant du nickel{{note|groupe=Note|Il sert ensuite à qualifier un gisement.}}. Le ''nickelage'' désigne avant le milieu du {{s|XIX}} l'action du verbe ''nickeler'', c'est-à-dire couvrir d'une mince couche de nickel, ainsi que le revêtement métallique de nickel protecteur, c'est-à-dire le résultat du verbe nickeler en [[galvanoplastie]]{{note|groupe=Note|Ce verbe se conjugue à l'instar du verbe appeler, ainsi je nickelle…}}. L'adjectif ''nickelé'' qualifie un métal ou un alliage recouvert d'une couche de nickel<ref>Cet adjectif est dans le ''Dictionnaire universel'' rédigé par [[Louis-Nicolas Bescherelle]], en 1845. Le verbe nickeler est cité en 1853 dans le ''Dictionnaire des arts et manufactures'' rédigé sous l'autorité de l'ingénieur et fondeur [[Charles-Pierre Lefebvre de Laboulaye|Laboulaye]] dès 1847.</ref>. En 1857, la ''nickelure'' désigne une technique particulière, à préciser, par laquelle les métaux peuvent être nickelés et de manière générale, l'art de nickeler et le travail fait par nickelage<ref>Le terme nickelure est présent dans le ''[[Journal officiel]]'', en 1875. Plus tard, à la [[Belle Époque]], apparaissent le verbe « nickeliser » et le substantif « nickelisage ».</ref>. Le chimiste [[Charles Adolphe Wurtz|Adolphe Wurtz]] popularise en 1873 l'adjectif ''nickélique'' pour qualifier certains composés de nickel{{note|groupe=Note|L'adjectif désigne ensuite communément ce qui a rapport au nickel.}}. L'alliage NiCr ou nickelchrome est mentionné dans le ''[[Grand Larousse encyclopédique]]'' en 1932. |
||
== Isotopes == |
== Isotopes == |
||
{{Article détaillé|Isotopes du nickel}} |
{{Article détaillé|Isotopes du nickel}} |
||
Le nickel possède 31 [[isotope]]s de nombre de masse variant entre 48 et 78, ainsi que sept [[isomérie nucléaire|isomères nucléaires]]. Il existe dans la nature sous la forme de cinq [[isotope stable|isotopes stables ou quasi stables]] : {{exp|58}}Ni, {{exp|60}}Ni, {{exp|61}}Ni, {{exp|62}}Ni et {{exp|64}}Ni, {{exp|58}}Ni étant le plus abondant ([[abondance naturelle]] de 68,077 %<ref>{{lien web|langue=en|url=http://education.jlab.org/itselemental/iso028.html|titre=Isotopes of the Element Nickel|série=[http://education.jlab.org/ Science education]|éditeur=[http://jlab.org/ Jefferson Lab]}}</ref>). On lui attribue une masse atomique standard de 58,6934(2) [[unité de masse atomique unifiée|u]]. |
Le nickel possède 31 [[isotope]]s de [[nombre de masse]] variant entre 48 et 78, ainsi que sept [[isomérie nucléaire|isomères nucléaires]]. Il existe dans la nature sous la forme de cinq [[isotope stable|isotopes stables ou quasi stables]] : {{exp|58}}Ni, {{exp|60}}Ni, {{exp|61}}Ni, {{exp|62}}Ni et {{exp|64}}Ni, {{exp|58}}Ni étant le plus abondant ([[abondance naturelle]] de 68,077 %<ref>{{lien web|langue=en|url=http://education.jlab.org/itselemental/iso028.html|titre=Isotopes of the Element Nickel|série=[http://education.jlab.org/ Science education]|éditeur=[http://jlab.org/ Jefferson Lab]}}.</ref>). On lui attribue une masse atomique standard de {{nobr|58,6934(2) [[unité de masse atomique unifiée|u]]}}. Vingt-six [[radioisotope]]s ont été caractérisés, le plus stable étant {{exp|59}}Ni avec une demi-vie de {{unité|76000 ans}}, suivi de {{exp|63}}Ni ({{nobr|100,1 ans}}) et de {{exp|56}}Ni ({{unité|6077 j}}). Tous les autres radioisotopes ont une demi-vie inférieure à {{unité|60 h}}, et la plupart inférieure à {{unité|30 s}}. |
||
== Occurrences de l'élément, extraction minière et purification == |
== Occurrences de l'élément, extraction minière et purification == |
||
Le nickel est le {{5e}} élément le plus abondant dans la Terre (2,4 %), mais loin derrière les quatre premiers ([[fer]] : 35 %, [[oxygène]] : 30 %, [[silicium]] : 15 %, [[magnésium]] : 13 %)<ref>{{Ouvrage| langue=en| auteur1=James Girard| titre=Principles of Environmental Chemistry| éditeur=Jones & Bartlett Learning| année=2005| pages totales=677| passage=9| isbn=978-0-7637-2471-9| lire en ligne=https://books.google.com/books?id=7vsB6dsfLkkC&pg=PA9}}.</ref>. C'est le {{24e}} dans la [[croûte terrestre]], avec un [[clarke (grandeur)|clarke]] de {{unité|75 à 80 |
Le nickel est le {{5e}} élément le plus abondant dans la Terre (2,4 %), mais loin derrière les quatre premiers ([[fer]] : 35 %, [[oxygène]] : 30 %, [[silicium]] : 15 %, [[magnésium]] : 13 %)<ref>{{Ouvrage| langue=en| auteur1=James Girard| titre=Principles of Environmental Chemistry| éditeur=Jones & Bartlett Learning| année=2005| pages totales=677| passage=9| isbn=978-0-7637-2471-9| lire en ligne=https://books.google.com/books?id=7vsB6dsfLkkC&pg=PA9}}.</ref>. C'est le {{24e}} dans la [[croûte terrestre]], avec un [[clarke (grandeur)|clarke]] de {{unité|75 à 80 g/t}} ({{unité|75-80 ppm}}) selon les estimations<ref>Alain Foucault, {{opcit}}</ref>, et le {{9e}} dans le [[manteau terrestre|manteau]] avec {{unité|1860 ppm}}<ref>{{lien web| langue=en| url=http://www.knowledgedoor.com/2/elements_handbook/element_abundances_in_the_earth_s_mantle.html| titre=Element Abundances in the Earth's Mantle| consulté le=9 juin 2019}}.</ref>. C'est en revanche un élément majeur du [[noyau terrestre|noyau]], le {{2e}} (après le fer) dans le [[noyau interne]] (environ 20 %) et le {{2e}} ou le {{3e}} dans le [[noyau externe]] (environ 5 %). |
||
Le nickel métallique existe à l'état naturel, c'est le [[nickel natif]], qui contient souvent divers autres métaux comme impuretés. Les [[météorite]]s métalliques, dites [[météorite de fer|météorites de fer]], sont constituées d'un alliage fer-nickel (comme le noyau terrestre, et c'est aussi le cas des [[astéroïde]]s de [[astéroïde de type M|type M]]. Les [[nodule polymétallique|nodules polymétalliques]] des profondeurs océaniques sont à base de [[manganèse|Mn]], Ni, [[cobalt|Co]], [[fer|Fe]], [[chrome|Cr]]{{etc.}} |
Le nickel métallique existe à l'état naturel, c'est le [[nickel natif]], qui contient souvent divers autres métaux comme impuretés. Les [[météorite]]s métalliques, dites [[météorite de fer|météorites de fer]], sont constituées d'un alliage fer-nickel (comme le noyau terrestre, et c'est aussi le cas des [[astéroïde]]s de [[astéroïde de type M|type M]]. Les [[nodule polymétallique|nodules polymétalliques]] des profondeurs océaniques sont à base de [[manganèse|Mn]], Ni, [[cobalt|Co]], [[fer|Fe]], [[chrome|Cr]]{{etc.}} |
||
[[Fichier:Garnierite in nickeliferous limonite Hydrous magnesium nickel silicate Nickel Mountain, near Riddle, Douglas County, Oregon 2908.jpg|gauche|vignette|179x179px|Garniérite enveloppé dans la limonite nickélifère, Montagne du Nickel, près de Riddle, comté Douglas, Oregon.]] |
[[Fichier:Garnierite in nickeliferous limonite Hydrous magnesium nickel silicate Nickel Mountain, near Riddle, Douglas County, Oregon 2908.jpg|gauche|vignette|179x179px|Garniérite enveloppé dans la limonite nickélifère, Montagne du Nickel, près de Riddle, comté Douglas, Oregon.]] |
||
[[Fichier:CSIRO ScienceImage 1228 Nickel Ore in Nickel Mine.jpg|vignette|Minerai de sulfures de nickel à texture de spinifex, Lunnon Shoot, Kambalda, en [[Australie-Occidentale]].]] |
[[Fichier:CSIRO ScienceImage 1228 Nickel Ore in Nickel Mine.jpg|vignette|Minerai de sulfures de nickel à texture de spinifex, Lunnon Shoot, Kambalda, en [[Australie-Occidentale]].]] |
||
Le nickel se substitue facilement au [[fer]] ou au [[magnésium]] dans divers silicates de la croûte et du manteau, en particulier ceux des roches magmatiques alcalines ou basiques, voire ultrabasiques comme les [[péridot]]s et les [[pyroxène]]s. Les [[péridotite]]s peuvent en contenir plus de {{unité|3.1|kg}} par tonne. Ainsi le nickel apparaît sous forme de silicates ou hydrosilicates, comme les variétés de [[Serpentine (minéral)|serpentine]]s comme la [[garniérite]] ou nouméite, un silicate complexe de nickel et de magnésium de formule simplifiée {{fchim|(Ni,Mg)|3|[Si|2|O|5|](OH)|4|)}} qui peut être aussi considéré comme un composant de roches détritiques ou de latérites<ref>Un nom générique ancien de ces silicates hydratés naturel de Ni, Mg et Ca est ''nickelgymnite'' ou ''gymnite nickélifère''. Autrefois les dénominations ''nouméite'' et ''garniérite'' désignaient respectivement les variétés riches ou pauvres en Ni.</ref>. Comme ces derniers assemblages à garniérite sont dénommés minerais saprolithiques, l'adjectif latéritique qualifie souvent les formations plus altérées, à base de limonites nickélifè̠res {{fchim|(Fe, Ni)O(OH). n H|2|O|}}. |
|||
Le nickel se substitue facilement au [[fer]] ou au [[magnésium]] dans divers silicates de la croûte et du manteau, en particulier ceux des roches magmatiques alcalines ou basiques, voire ultrabasiques comme les [[péridot]]s et les [[pyroxène]]s. Les [[péridotite]]s peuvent en contenir plus de {{unité|3.1 kg/t}}. Ainsi le nickel apparaît sous forme de silicates ou hydrosilicates, comme les variétés de [[Serpentine (minéral)|serpentine]]s comme la [[garniérite]] ou nouméite, un silicate complexe de nickel et de magnésium de formule simplifiée {{fchim|(Ni,Mg)|3|[Si|2|O|5|](OH)|4}} qui peut être aussi considéré comme un composant de roches détritiques ou de latérites{{note|groupe=Note|Un nom générique ancien de ces silicates hydratés naturel de Ni, Mg et Ca est ''nickelgymnite'' ou ''gymnite nickélifère''. Autrefois les dénominations ''nouméite'' et ''garniérite'' désignaient respectivement les variétés riches ou pauvres en Ni.}}. Comme ces derniers assemblages à garniérite sont dénommés minerais saprolithiques, l'adjectif latéritique qualifie souvent les formations plus altérées, à base de limonites nickélifè̠res {{fchim|(Fe, Ni)O(OH). {{mvar|n}} H|2|O}}. |
|||
On le trouve sous forme combinée au [[soufre]] dans la [[millérite]] {{fchim|NiS}}, la [[polydymite]] {{fchim|Ni|3|S|4|}}, la pyrrolite {{fchim|(Fe,Ni)S}}, la [[pentlandite]] {{fchim|(Ni,Fe)|9|S|8|}} très souvent insérées dans une matrice rocheuse à base de [[pyrrhotite]]. Il s'agit de chalcopyrite {{fchim|CuFeS|2|}} ou de pyrrhotite nickélifère des anciens auteurs. |
|||
On le trouve sous forme combinée au [[soufre]] dans la [[millérite]] NiS, la [[polydymite]] {{fchim|Ni|3|S|4}}, la pyrrolite (Fe,Ni)S, la [[pentlandite]] {{fchim|(Ni,Fe)|9|S|8}} très souvent insérées dans une matrice rocheuse à base de [[pyrrhotite]]. Il s'agit de chalcopyrite {{fchim|CuFeS|2}} ou de pyrrhotite nickélifère des anciens auteurs. |
|||
Combiné à l'[[arsenic]] ou sous forme d'arséniures ou d'arséniates, il est présent dans la [[nickéline]] ou niccolite NiAs de couleur rouge, de chloantite {{fchim|NiAs|3}}, de [[smaltite]], l'[[annabergite]] ou « nickel ocre » {{fchim|Ni|3|(AsO|4|)|2|. 8 H|2|O}}, d'[[aerugite]]{{etc.}} |
|||
Il apparaît aussi sous forme d'oxydes, de sulfates, de carbonates, de phosphates, d'antimoniures ([[breithauptite]] ou alliage {{fchim|NiSb}}), de [[phosphure de nickel|phosphures]], de sulfoarséniures ([[gersdorffite]] {{fchim|NiAsS}} ou disomose)... Tous ces minéraux sont liés à des gîtes associés à des roches magmatiques, parfois ayant constitués des filons excentrés. |
|||
Il apparaît aussi sous forme d'oxydes, de sulfates, de carbonates, de phosphates, d'antimoniures ([[breithauptite]] ou alliage NiSb), de [[phosphure de nickel|phosphures]], de sulfoarséniures ([[gersdorffite]] NiAsS ou disomose){{etc.}} Tous ces minéraux sont liés à des gîtes associés à des roches magmatiques, parfois ayant constitués des filons excentrés. |
|||
=== Minerais et extraction minière === |
=== Minerais et extraction minière === |
||
{{article détaillé|Minerai|Extraction du nickel}} |
{{article détaillé|Minerai|Extraction du nickel}} |
||
[[Fichier:Nickel Nodule obtained by Electroplating.jpg|vignette|Nodules de nickel obtenu par électrolyse.|245x245px]] |
|||
Les [[minerai]]s de nickel étaient connus en [[France]] au {{s-|XIX}} dans les [[Pyrénées]], les [[Alpes]] ou en [[Algérie]]. L'[[extraction du nickel]] est compliquée par les associations fréquentes avec Fe, Cu, Co{{etc.}} Les minerais sulfurés préalablement oxydés ou grillés étaient réduits par la vapeur d'eau. Pour purifier efficacement le nickel, il faut attendre le [[procédé Mond]] qui utilise la formation entre {{tmp|60|°C}} et {{tmp|80|°C}} du [[tétracarbonyle de nickel]] {{fchim|Ni(CO)|4|}} volatile et la pyrolyse de ce corps instable vers {{tmp|180|°C}}, laissant un dépôt de nickel métal. |
|||
Les [[minerai]]s de nickel sont connus en [[France]] au {{s-|XIX}} dans les [[Pyrénées]], les [[Alpes]] ou en [[Algérie]]. L'[[extraction du nickel]] est compliquée par les associations fréquentes avec Fe, Cu, Co{{etc.}} Les minerais sulfurés préalablement oxydés ou grillés étaient réduits par la vapeur d'eau. Pour purifier efficacement le nickel, il faut attendre le [[procédé Mond]] qui utilise la formation entre {{tmp|60|°C}} et {{tmp|80|°C}} du [[tétracarbonyle de nickel]] {{fchim|Ni(CO)|4}} volatil et la pyrolyse de ce corps instable vers {{tmp|180|°C}}, laissant un dépôt de nickel métal. |
|||
Le nickel est communément présent dans les résidus de la préparation du [[smalt]], à base de sulfoarséniures de nickel parfois dénommé [[speiss]]. Le grillage du speiss permet d'obtenir du nickel impur, qui peut être purifié après quelques étapes réitérées d' |
Le nickel est communément présent dans les résidus de la préparation du [[smalt]], à base de sulfoarséniures de nickel parfois dénommé [[speiss]]. Le grillage du speiss permet d'obtenir du nickel impur, qui peut être purifié après quelques étapes réitérées d'affinage. |
||
Le nickel ou plutôt le silicate de magnésie et de nickel préalablement décrit a longtemps constitué la principale richesse de la [[Nouvelle-Calédonie]], |
Le nickel, ou plutôt le silicate de magnésie et de nickel préalablement décrit, a longtemps constitué la principale richesse de la [[Nouvelle-Calédonie]], découverte par l'ingénieur [[Jules Garnier]] en [[1864]]. Le minerai est exploité à partir d'une teneur supérieure à 0,5 % en masse dans les {{nobr|années 1990}}. Ce territoire autonome possède environ 30 % des réserves mondiales, estimées alors à plus de {{nobr|174 millions}} de tonnes. |
||
Dans les années 1990, les autres pays producteurs |
Dans les années 1990, les autres pays producteurs sont la Russie, le Canada, l'Australie et Cuba, les États-Unis. Des gisements importants sont exploités en [[Russie]], dans la région de [[Norilsk]]. 27 % de la production mondiale de nickel proviennent de mines situées dans le [[cratère d'impact]] d'une énorme météorite dite de [[Bassin de Sudbury|Sudbury]] il y a {{nobr|1,8 milliard}} d'années<ref>[[André Brahic]], ''De feu et de glace'', éd. Odile Jacob, 2010 {{ISBN|978-2-7381-2330-5}}.</ref>. |
||
Au début du {{s-|XXI}}, le nickel est extrait de deux types de minerais : les [[latérite]]s et les [[sulfure]]s de nickel, ces derniers exploités dans de nombreux gisements dans le monde, en association avec des roches mafiques et ultramafiques. Deux principaux contextes géologiques |
Au début du {{s-|XXI}}, le nickel est extrait de deux types de minerais : les [[latérite]]s et les [[sulfure]]s de nickel, ces derniers exploités dans de nombreux gisements dans le monde, en association avec des roches mafiques et ultramafiques. Deux principaux contextes géologiques sont caractérisés : |
||
* les [[Complexe igné|complexes ignés]] lités, vastes ensembles magmatiques issus du manteau, exploité notamment dans l'Oural ([[Norilsk Nickel|Norilsk]]), le bouclier canadien ([[Grand Sudbury|Sudbury]]), et la province de Gansu en Chine (Jinchuan) ; |
|||
* le volcanisme mantellique primitif riche en magnésium de l'Archéen, ou [[komatiite]], formant des gisements par exemple en Australie ([[Kambalda]]), au Québec ([[Mine Raglan|Raglan]]) ou au Brésil. Tous ces gisements associent le nickel avec le cuivre, souvent le cobalt et les éléments du groupe du platine. Certains gisements sont associés à des niveaux de shales noirs, notamment à [[Sotkamo]] en Finlande. |
|||
Mais bien que 70 % des [[Réserves (ressource)|réserves]] de nickel soient des minerais latéritiques, ceux-ci ne correspondent qu'à 40 % de la production mondiale. Les minerais latéritiques sont essentiellement destinés à la production de [[ferronickel]], les minerais sulfureux, par l'intermédiaire de [[Matte (métallurgie)|matte]]s, étant généralement |
Mais bien que 70 % des [[Réserves (ressource)|réserves]] de nickel soient des minerais latéritiques, ceux-ci ne correspondent qu'à 40 % de la production mondiale. Les minerais latéritiques sont essentiellement destinés à la production de [[ferronickel]], les minerais sulfureux, par l'intermédiaire de [[Matte (métallurgie)|matte]]s, étant généralement destinés à la production de nickel très pur<ref name="ExtractiveMetallurgyNickel">{{Ouvrage |langue=en |prénom1=Frank K. |nom1=Krundwell |prénom2=Michael S. |nom2=Moats |prénom3=Venkoba |nom3=Ramachandran |prénom4=Timothy G. |nom4=Robinson |prénom5=William G. |nom5=Davenport |titre=Extractive Metallurgy of Nickel, Cobalt and Platinum Group Metals |éditeur=[[Elsevier (éditeur)|Elsevier]] |année=2011 |pages totales=610 |passage=1-15 ; 27-32 |isbn=978-0-08-096809-4 |lire en ligne=https://books.google.com/books?id=yx5L85iuOicC&printsec=frontcover}}.</ref>. Le grillage des sulfures s'opère au moins entre {{tmp|500|°C}} et {{tmp|700|°C}}{{note|groupe=Note|Cette opération explique le dégagement de [[dioxyde de soufre]] {{fchim|SO|2}}.}}. Les matières fondues subissent ensuite des procédés classiques d'[[hydrométallurgie]]. |
||
Qu'ils soient latéritiques ou sulfureux, les minerais de nickel sont exploités dès que leur richesse dépasse 1,3 % de nickel<ref name=ExtractiveMetallurgyNickel/>. Cette faible teneur explique la complexité et la diversité des procédés, déterminés par la nature de la [[gangue]] du minerai, ainsi que par la qualité du nickel désiré à la fin de l'extraction. |
Qu'ils soient latéritiques ou sulfureux, les minerais de nickel sont exploités dès que leur richesse dépasse 1,3 % de nickel<ref name=ExtractiveMetallurgyNickel/>. Cette faible teneur explique la complexité et la diversité des procédés, déterminés par la nature de la [[gangue]] du minerai, ainsi que par la qualité du nickel désiré à la fin de l'extraction. |
||
[[Fichier:Nickel Nodule obtained by Electroplating.jpg|vignette|Nodules de nickel obtenu par électrolyse.|245x245px]] |
|||
== Propriétés physiques et chimiques du corps simple métal, préparation et alliages == |
== Propriétés physiques et chimiques du corps simple métal, préparation et alliages == |
||
[[Image:Nickel chunk.jpg|gauche|vignette|Bloc de nickel pur.]] |
|||
Le nickel est un métal blanc argenté, parfois légèrement grisâtre, de densité 8,9. Il existe sous deux [[Allotropie|variétés allotropiques]], le {{fchim|Ni{{ind|α}}}} hexagonale instable et le {{fchim|Ni{{ind|β}}}} cubique face centrée, variété la plus stable. |
|||
Ce corps cristallin de maille cubique est souvent déjà brillant, il possède un bel éclat brillant par polissage. Il fait partie du groupe des métaux non-ferreux<ref>{{Lien web|langue = Français|titre = Metaux non Ferreux|url = http://www.federec.org/les-nouvelles-matieres-premieres/metaux-non-ferreux|site = Fédération des entreprises du recyclage|consulté le = 23/10/2014}}</ref>. Le nickel est classé comme [[métal de transition]], c'est un corps solide assez dur, le plus dur des métaux après le [[chrome]], tenace, [[Ductilité|ductile]], [[malléabilité|malléable]], en particulier plus malléable que le cobalt. Pour le métallurgiste, les propriétés mécaniques du nickel sont voisines de celles du fer. Il se laisse laminer et étirer en fils assez fins. |
|||
[[Fichier:Nickel sheet, 1.7 grams, 1 x 2 cm..jpg|vignette|Plaquette centimétrique de nickel malléable|182x182px]] |
|||
Le nickel est bon conducteur de la chaleur et de l'électricité. Il est [[ferromagnétique]]. |
|||
{{clr}} |
|||
=== Propriétés physiques === |
=== Propriétés physiques === |
||
[[Fichier:Nickel chunk.jpg|gauche|vignette|Bloc de nickel pur.]] |
|||
La [[maille (cristallographie)|maille]] du nickel β est [[cubique à faces centrées]] avec un [[paramètre cristallin]] de {{unité|0.352|nm}}, ce qui correspond à un [[rayon atomique]] de {{unité|0.124|nm}}. Cette structure cristalline est stable jusqu'aux pressions d'au moins {{unité|70|[[Pascal (unité)|GPa]]}}. |
|||
Le nickel est un métal blanc argenté, parfois légèrement grisâtre, de densité 8,9. Il existe sous deux [[Allotropie|variétés allotropiques]], le Ni{{ind|α}} hexagonal instable et le Ni{{ind|β}} cubique à faces centrées, variété la plus stable. |
|||
[[Fichier:NickelCoupon.jpg|vignette|Plaque-coupon de nickel|223x223px]] |
|||
Ce corps cristallin de maille cubique est souvent déjà brillant, il possède un bel éclat brillant par polissage. Il fait partie du groupe des métaux non-ferreux<ref>{{Lien web|titre = Metaux non Ferreux|url = http://www.federec.org/les-nouvelles-matieres-premieres/metaux-non-ferreux|site = Fédération des entreprises du recyclage|consulté le = 23/10/2014}}.</ref>. Le nickel est classé comme [[métal de transition]], c'est un corps solide assez dur, le plus dur des métaux après le [[chrome]], tenace, [[Ductilité|ductile]], [[malléabilité|malléable]], en particulier plus malléable que le cobalt. Pour le métallurgiste, les propriétés mécaniques du nickel sont voisines de celles du fer. Il se laisse laminer et étirer en fils assez fins. |
|||
[[Fichier:Nickel sheet, 1.7 grams, 1 x 2 cm..jpg|vignette|Plaquette centimétrique de nickel malléable.|182x182px]] |
|||
Le nickel est bon conducteur de la chaleur et de l'électricité. Il est [[Ferromagnétisme|ferromagnétique]] aux températures ordinaires{{note|groupe=Note|Il est pratiquement aussi magnétique que le fer.}}. Seuls trois autres éléments possèdent cette propriété : le [[fer]], le [[cobalt]] et le [[gadolinium]]. Sa [[température de Curie]] est de {{tmp|355|°C}}, ce qui signifie que le nickel solide est non magnétique ([[Paramagnétisme|paramagnétique]]) au-dessus de cette température<ref>{{Ouvrage|auteur1=Kittel, Charles|titre=Introduction to Solid State Physics|éditeur=[[John Wiley & Sons|Wiley]]|année=1996|passage=449|isbn=0-471-14286-7}}.</ref>. En pratique, le [[champ magnétique]] s'atténue dès {{tmp|250|°C}}.. |
|||
La [[maille (cristallographie)|maille]] du nickel β est [[cubique à faces centrées]] avec un [[paramètre cristallin]] de {{unité|0.352|nm}}, ce qui correspond à un [[rayon atomique]] de {{unité|0.124|nm}}. Cette structure cristalline est stable jusqu'aux pressions d'au moins {{nobr|70 [[Pascal (unité)|GPa]]}}. |
|||
[[Fichier:NickelCoupon.jpg|vignette|Plaque-coupon de nickel.|223x223px]] |
|||
Le nickel, comme le cobalt, est plus tenace que le fer. Sa cassure est fibreuse. Métal moins fusible que le fer, mais plus fusible que le chrome, il est facile à travailler. Sa densité apparente peut varier après écrouissage, les pièces montrant une densité apparente passant de 8,3 à 8,8. |
Le nickel, comme le cobalt, est plus tenace que le fer. Sa cassure est fibreuse. Métal moins fusible que le fer, mais plus fusible que le chrome, il est facile à travailler. Sa densité apparente peut varier après écrouissage, les pièces montrant une densité apparente passant de 8,3 à 8,8. |
||
Le corps simple est dilatable par la chaleur. La conductivité électrique est 24 % IACS, c'est-à-dire moins du quart que celle du [[cuivre]] pur. Il est fusible au-dessus de {{tmp|1452|°C}} et, très pur, bout vers {{tmp|2730|°C}}. |
Le corps simple est dilatable par la chaleur. La conductivité électrique est 24 % IACS, c'est-à-dire moins du quart que celle du [[cuivre]] pur. Il est fusible au-dessus de {{tmp|1452|°C}} et, très pur, bout vers {{tmp|2730|°C}}. |
||
Le nickel [[paramagnétique]] est [[ferromagnétisme|ferromagnétique]] aux températures ordinaires<ref>Il est pratiquement aussi magnétique que le fer.</ref>. Seuls trois autres éléments possèdent cette propriété: le [[fer]], le [[cobalt]] et le [[gadolinium]]. Sa [[température de Curie]] est de {{tmp|355|°C}}, ce qui signifie que le nickel solide est non magnétique au-dessus de cette température<ref>{{Ouvrage|auteur1=Kittel, Charles|titre=Introduction to Solid State Physics|éditeur=[[John Wiley & Sons|Wiley]]|année=1996|passage=449|isbn=0-471-14286-7}}.</ref>. En pratique, le champ magnétique s'atténue dès {{tmp|250|°C}}. |
|||
=== Propriétés chimiques, stabilité de la surface métal et nickelage === |
=== Propriétés chimiques, stabilité de la surface métal et nickelage === |
||
Le nickel est stable à l'air et à l'eau. Le nickel ne s'oxyde pas facilement à l'air humide. Le nickel ne s'oxyde pas à l'air froid, l'oxydation existe à l'air très chaud, et d'autant plus importante avec la température croissante. Un fil fin de nickel chauffé brûle dans le gaz oxygène pur. La mousse de nickel, corps poudreux très divisé à haute surface spécifique, peut s'enflammer dans l'air, une fois soumise à un point chaud ou à une étincelle. Le [[nickel de Raney]] est un corps [[pyrophorique]]. |
Le nickel est stable à l'air et à l'eau. Le nickel ne s'oxyde pas facilement à l'air humide. Le nickel ne s'oxyde pas à l'air froid, l'oxydation existe à l'air très chaud, et d'autant plus importante avec la température croissante. Un fil fin de nickel chauffé brûle dans le gaz oxygène pur. La mousse de nickel, corps poudreux très divisé à haute surface spécifique, peut s'enflammer dans l'air, une fois soumise à un point chaud ou à une étincelle. Le [[nickel de Raney]] est un corps [[pyrophorique]]. |
||
Le métal nickel pulvérulent est un super-[[Adsorption|adsorbant]] de molécules gazeuses, comme l'hydrogène ou le [[monoxyde de carbone]]. Il peut retenir et libérer facilement plus de {{unité|8|litres}} de monoxyde de carbone. Les |
Le métal nickel pulvérulent est un super-[[Adsorption|adsorbant]] de molécules gazeuses, comme l'[[Dihydrogène|hydrogène]] ou le [[monoxyde de carbone]]. Il peut retenir et libérer facilement plus de {{unité|8|litres}} de monoxyde de carbone. Les « mousses de nickel », mises au point au cours des {{nobr|années 1980}}, ont révolutionné la [[catalyse]], notamment en hydrogénation, de même que l'électrochimie. |
||
Le nickel massif est attaqué lentement par les acides non oxydants. Le nickel est facilement dissout dans l'[[acide sulfurique]] et l'[[acide chlorhydrique]] avec dégagement de gaz hydrogène. La réaction de dissolution peut être conduite dans ces acides dilués ou étendus d'eau. |
Le nickel massif est attaqué lentement par les acides non oxydants. Le nickel est facilement dissout dans l'[[acide sulfurique]] et l'[[acide chlorhydrique]] avec dégagement de gaz hydrogène. La réaction de dissolution peut être conduite dans ces acides dilués ou étendus d'eau. |
||
: |
: Ni {{ind|solide}} + 2 {{fchim|H|3|O{{exp|+}}}}{{ind|aq ions hydronium en milieu non oxydant}} + 4 {{H2O}} {{ind|eau}} → {{formule chimique|[Ni(H|2|O)|6|]{{exp|2+}}}} {{ind|cation nickel hydraté vert}} + {{H2}} {{ind|gaz}} |
||
Mis en contact avec l'[[acide nitrique]] concentré, la surface du métal devient [[passivation|passive]], au même titre que la passivité du fer |
Mis en contact avec l'[[acide nitrique]] concentré, la surface du métal devient [[passivation|passive]], au même titre que la passivité du fer{{note|groupe=Note|Même remarque pour le nickel avec l'[[eau régale]].}}. En pratique, s'il est attaqué rapidement par l'acide nitrique dilué, le métal Ni est insoluble dans les acides oxydants concentrés. De manière générale, en condition oxydante, l'attaque est lente. |
||
[[Fichier:Laboratory apparatus for reactions with fluorine gas.jpg|vignette|L'alliage monel ou à défaut le nickel est utilisé dans les montages ou appareillages de laboratoire faisant intervenir le gaz [[Difluor|fluor]] ou l'[[acide fluorhydrique]].|263x263px]] |
[[Fichier:Laboratory apparatus for reactions with fluorine gas.jpg|vignette|L'alliage monel ou à défaut le nickel est utilisé dans les montages ou appareillages de laboratoire faisant intervenir le gaz [[Difluor|fluor]] ou l'[[acide fluorhydrique]].|263x263px]] |
||
| Ligne 94 : | Ligne 100 : | ||
Le nickel est insoluble dans le solvant [[ammoniac]]. |
Le nickel est insoluble dans le solvant [[ammoniac]]. |
||
Ainsi le métal en plaque ou en revêtement de [[nickelage]] pour protéger des métaux oxydables résiste bien à la corrosion et à l'exposition durable à l'air humide, en formant une couche d'oxyde passivante ou protectrice |
Ainsi le métal en plaque ou en revêtement de [[nickelage]] pour protéger des métaux oxydables résiste bien à la corrosion et à l'exposition durable à l'air humide, en formant une couche d'oxyde passivante ou protectrice NiO. Il prend souvent une teinte blanc grisâtre. |
||
Le nickel reste le plus souvent intact en solution neutre ou alcaline, en présence d'eau de mer, ou exposé à des conditions atmosphériques clémentes. |
Le nickel reste le plus souvent intact en solution neutre ou alcaline, en présence d'eau de mer, ou exposé à des conditions atmosphériques clémentes. |
||
| Ligne 103 : | Ligne 109 : | ||
=== Préparation du corps simple, production === |
=== Préparation du corps simple, production === |
||
L'oxyde de nickel était préparé, à partir des arséniures ou sulfo-arséniures de nickel selon les techniques du laboratoire de Georg Brandt, par chauffage avec du soufre |
L'oxyde de nickel était préparé, à partir des arséniures ou sulfo-arséniures de nickel selon les techniques du laboratoire de Georg Brandt, par chauffage avec du soufre S et du carbonate de potasse {{fchim|K|2|CO|3}}, qui donne de la potasse caustique par chauffage. |
||
La récupération du [[sulfure de nickel]] était également possible. Les minerais sont traités par le pentasulfure de potassium {{fchim|K|5|S|5 |
La récupération du [[sulfure de nickel]] était également possible. Les minerais sont traités par le pentasulfure de potassium {{fchim|K|5|S|5}}, ce dernier corps étant soluble dans l'eau alors que le sulfure de nickel est insoluble. |
||
Le sulfure de nickel, qui peut aussi être un minerai sulfuré concentré, était ensuite grillé, puis traité par l'[[acide sulfurique]] selon un procédé ancien mis au point au laboratoire de [[Friedrich Wöhler]]. le soufre part sous la forme de gaz [[hydrogène sulfuré]]. Le traitement ultérieur par la potasse donnait un |
Le sulfure de nickel, qui peut aussi être un minerai sulfuré concentré, était ensuite grillé, puis traité par l'[[acide sulfurique]] selon un procédé ancien mis au point au laboratoire de [[Friedrich Wöhler]]. le soufre part sous la forme de gaz [[hydrogène sulfuré]]. Le traitement ultérieur par la potasse donnait un « oxyde de nickel hydraté » ou {{fchim|Ni(OH)|2}} vert pomme, insoluble. |
||
Au laboratoire, l'oxyde de nickel était ensuite réduit à basse température en tube de verre sous un balayage de gaz [[Dihydrogène|hydrogène]]. |
Au laboratoire, l'oxyde de nickel était ensuite réduit à basse température en tube de verre sous un balayage de gaz [[Dihydrogène|hydrogène]]. |
||
: NiO {{ind|solide}} + {{ |
: NiO {{ind|solide}} + {{H2}} {{ind|gaz}} → Ni {{ind|métal pulvérulent}} + {{H2O}} {{ind|vapeur ou liquide évaporé}} |
||
Les chimistes obtenaient une poudre pulvérulente, réactive et |
Les chimistes obtenaient une poudre pulvérulente, réactive et « pyrophorique » puisqu'elle s'enflammait à l'air, une fois mis en contact avec le gaz [[Dioxygène|oxygène]] composant minoritaire de l'[[air]]. L'industrie procédait par une réduction moins coûteuse au charbon, dans un creuset réfractaire, pour obtenir un nickel impur, la poudre métal du commerce contenant les corps simple cobalt, cuivre et fer. |
||
Pour obtenir un nickel purifié, l'oxyde de nickel était traité à l'[[acide oxalique]], et l'oxalate de nickel {{fchim|2NiO. C|4|O|6 |
Pour obtenir un nickel purifié, l'oxyde de nickel était traité à l'[[acide oxalique]], et l'oxalate de nickel {{fchim|2NiO. C|4|O|6}} obtenu chauffé au feu de forge en vase clos se décomposait en corps simple Ni et en [[dioxyde de carbone]]. Le nickel était réduit dans un creuset fermé adapté, le métal se plaçant au culot. |
||
[[image:Extraction nickel Français.svg|vignette|upright=1.7|Principales filières métallurgiques pour l'extraction du nickel.|alt=arborescence des opérations métallurgique]] |
|||
Le principal problème technique était la séparation du nickel du cobalt. Les solutions salines concentrées, préparées avec un oxyde mixte de cobalt et de nickel, étaient neutralisées par la potasse. Au mélange était ajouté en excès une solution de [[Nitrite de potassium|nitrite de potasse]], avant qu'il soit mis au repos en milieu acide, par exemple en milieu [[acide acétique]], une journée. Le nitrite double de potassium et de cobalt {{fchim|CoK(NO|2|)|3|}} avait lentement précipité, et le précipité était récupéré par filtration de la solution, après un lavage soigneux avec une solution aqueuse de [[chlorure de potassium]]. Ce corps solide récupéré permettait de fabriquer le [[jaune de cobalt]], utilisé pour la peinture à l'[[aquarelle]]. La liqueur filtrée, contant l'ion nickel, était traité à l'[[Hydroxyde de potassium|hydroxyde de potasse]] pour précipiter un "oxyde de nickel hydraté" ou [[hydroxyde de nickel]]. |
|||
[[Fichier:Extraction nickel Français.svg|vignette|upright=1.7|Principales filières métallurgiques pour l'extraction du nickel.|alt=arborescence des opérations métallurgique]] |
|||
Tous les procédés d'extraction actuels combinent encore des techniques d'[[hydrométallurgie]] et de [[pyrométallurgie]], dont l'optimisation dépend fortement de la nature du minerai traité. L'activité est éminemment [[Intensité capitalistique|capitalistique]] : une usine produisant {{unité|60000|tonnes}} par an de [[ferronickel]] à partir de [[latérite]], coûte environ {{unité|4|milliards}} de dollars (Koniambo, [[Nouvelle-Calédonie]]), soit un investissement de {{unité|70000|dollars}} par tonne de nickel produite annuellement. Or en 2010, la tonne de nickel commercialisée sous la forme de ferronickel est cotée {{unité|26000|dollars}}. Le coût de transformation du minerai en ferronickel se situe à la même époque entre {{unité|4000|et=6000|dollars}} pour une usine performante : l'amortissement du capital explique la différence entre prix de vente et coût de production<ref name=ExtractiveMetallurgyNickel/>. |
|||
Le principal problème technique était la séparation du nickel du cobalt. Les solutions salines concentrées, préparées avec un oxyde mixte de cobalt et de nickel, étaient neutralisées par la potasse. Au mélange était ajouté en excès une solution de [[Nitrite de potassium|nitrite de potasse]], avant qu'il soit mis au repos en milieu acide, par exemple en milieu [[acide acétique]], une journée. Le nitrite double de potassium et de cobalt {{fchim|CoK(NO|2|)|3}} avait lentement précipité, et le précipité était récupéré par filtration de la solution, après un lavage soigneux avec une solution aqueuse de [[chlorure de potassium]]. Ce corps solide récupéré permettait de fabriquer le [[jaune de cobalt]], utilisé pour la peinture à l'[[aquarelle]]. La liqueur filtrée, contant l'ion nickel, était traité à l'[[Hydroxyde de potassium|hydroxyde de potasse]] pour précipiter un « oxyde de nickel hydraté » ou [[hydroxyde de nickel]]. |
|||
Tous les procédés d'extraction actuels combinent encore des techniques d'[[hydrométallurgie]] et de [[pyrométallurgie]], dont l'optimisation dépend fortement de la nature du minerai traité. L'activité est éminemment [[Intensité capitalistique|capitalistique]] : une usine produisant {{unité|60000 t/an}} de [[ferronickel]] à partir de [[latérite]], coûte environ quatre milliards de dollars (Koniambo, [[Nouvelle-Calédonie]]), soit un investissement de {{unité|70000 dollars}} par tonne de nickel produite annuellement. Or en 2010, la tonne de nickel commercialisée sous la forme de ferronickel est cotée {{unité|26000 dollars}}. Le coût de transformation du minerai en ferronickel se situe à la même époque entre {{unité|4000 et 6000 dollars}} pour une usine performante : l'amortissement du capital explique la différence entre prix de vente et coût de production<ref name=ExtractiveMetallurgyNickel/>. |
|||
Le nickel peut être moulu, fondu, mis en forme par moulage. Il est aussi facilement usinable et soudable. Le nickel se soude bien au fer. Autrefois, par laminage de tôles, issues d'un montage composé d'une lame d'acier prise entre deux plaques de nickel, étaient obtenues des tôles plaquées de nickel sur les deux faces. |
Le nickel peut être moulu, fondu, mis en forme par moulage. Il est aussi facilement usinable et soudable. Le nickel se soude bien au fer. Autrefois, par laminage de tôles, issues d'un montage composé d'une lame d'acier prise entre deux plaques de nickel, étaient obtenues des tôles plaquées de nickel sur les deux faces. |
||
| Ligne 125 : | Ligne 133 : | ||
{{Catégorie détaillée|Alliage de nickel}} |
{{Catégorie détaillée|Alliage de nickel}} |
||
Le nickel peut s'allier en principe avec tous les métaux, sauf avec le [[plomb]], l'[[argent]], le [[thorium]] et les [[métaux alcalins]]. |
Le nickel peut s'allier en principe avec tous les métaux, sauf avec le [[plomb]], l'[[argent]], le [[thorium]] et les [[Métal alcalin|métaux alcalins]]. |
||
Les alliages de Ni les plus courants sont avec les métaux Fe, Mn, Cr, Co, Cu, Zn, Al{{etc.}}, et les non-métaux comme le Si{{note|groupe=Note|Dans les {{nobr|années 1980}}, les alliages les plus importants étaient avec l'acier, le cuivre et l'aluminium.}}. Le nickel renforce notamment la résistance de l'acier à la rupture et à l'attaque chimique. |
|||
Les propriétés mécaniques et thermiques des alliages fabriqués sont remarquables, notamment la résistance à l'usure sur de vastes plages de températures, des basses températures à parfois plus de {{tmp|1000|°C}}. Ce sont des matériaux non ou très peu déformables, montrant souvent une quasi-absence de dilatation, une résistance aux réactifs chimiques et à la [[corrosion atmosphérique]], une très faible usure, des propriétés physiques, comme la [[résistance électrique]], peu influencées par le paramètre [[température]]. |
|||
Le nickel est présent dans un grand nombre d'alliages, des [[Acier inoxydable|aciers inoxydables]] et [[Matériau réfractaire|réfractaires]] à fortes teneurs en chrome et nickel aux fontes de nickel tels que le [[Ni-resist]], des alliages de [[blindage magnétique]], type alliage fer-nickel ou ferro-nickels très durs, sinimax {{fchim|Ni|0,43|Fe|0,54|Si|0,03}} et [[permalloy]] aux [[aimant]]s [[Aimant AlNiCo|Alnico]], des alliages résistants à la corrosion type [[hastelloy]] (par exemple hastelloy C résistant à la corrosion ou hastelloy D à grande résistance mécanique {{fchim|Ni|0,84|Cu|0,03|Fe|0,02|Si|0,075|Mn|0,02|Co|0,015}}, parfois au molybdène) ou des nickel-chrome ou chrome-nickel à l'[[Monel|alliage Monel]] à grande résistance à l'attaque chimique, principalement à base de Ni et Cu, par exemple {{fchim|Ni|0,65|Cu|0,27|Fe|0,02|Si|0,03|Mn|0,03}} ou aux divers [[cupronickel]]s, par exemple pour les pièces de monnaie ou encore le [[nigusil]]. |
|||
Les alliages de Ni les plus courants sont avec les métaux Fe, Mn, Cr, Co, Cu, Zn, Al... et les non-métaux comme le Si<ref>Dans les années 1980, les alliages les plus importants étaient avec l'acier, le cuivre et l'aluminium. </ref>. Le nickel renforce notamment la résistance de l'acier à la rupture et à l'attaque chimique. |
|||
Le nickel est pour le physicien métallurgiste un [[Austénite|élément gammagène]], c'est-à-dire qui stabilise la phase cubique à faces centrées, et, du coup, favorise l'obtention d'une [[Martensite|structure martensitique]] sur des pièces à grosses sections, en améliorant le résultat de la [[Trempe (métallurgie)|trempe]]. |
|||
Les propriétés mécaniques et thermiques des alliages fabriqués sont remarquables, notamment la résistance à l'usure sur de vastes plages de températures, des basses-températures à parfois plus de {{tmp|1000|°C}}. Ce sont des matériaux non ou très peu déformables, montrant souvent une quasi-absence de dilatation, une résistance aux réactifs chimiques et à la [[corrosion atmosphérique]], une très faible usure, des propriétés physiques, comme la [[résistance électrique]], peu influencées par le paramètre [[température]]... |
|||
[[Fichier:Nickel steel alloy.jpg|vignette|Acier au nickel, plus résistant à la rupture, à la corrosion, aux milieux de basses températures, voire à l'attaque chimique en milieu oxydant.]] |
|||
Le nickel est présent dans un grand nombre d'alliages, des [[Acier inoxydable|aciers inoxydables]] et [[Matériau réfractaire|réfractaire]]s à fortes teneurs en chrome et nickel aux fontes de nickel tels que le [[Ni-resist]], des alliages de [[blindage magnétique]], type alliage fer-nickel ou ferro-nickels très durs, sinimax {{fchim|Ni|0.43|Fe|0.54|Si|0.03|}} et [[permalloy]] aux aimants permanents [[Alnico]], des alliages résistants à la corrosion type [[hastelloy]] (par exemple hastelloy C résistant à la corrosion ou hastelloy D à grande résistance mécanique {{fchim|Ni|0.84|Cu|0.03|Fe|0.02|Si|0.075|Mn|0.02|Co|0.015|}}, parfois au molybdène) ou des nickel-chrome ou chrome-nickel à l'[[Monel|alliage Monel]] à grande résistance à l'attaque chimique, principalement à base de Ni et Cu, par exemple {{fchim|Ni|0.65|Cu|0.27|Fe|0.02|Si|0.03|Mn|0.03|}} ou aux divers [[cupro-nickel]]s, par exemple pour les pièces de monnaies ou encore le [[nigusil]]... |
|||
Pour les aciers faiblement alliés, par exemple à base de fer associé à 1,85 % de Ni, 0,8 % de Cr, 0,7 % de Mn, 0,4 % de C, 0,25 % de Mo, le nickel accroît la résistance mécanique, améliore indéniablement les propriétés à basses températures et la résistance à la corrosion. Pour un acier inoxydable austénitique classique, comme le 18/8 (Fe avec 18 % de Cr et 8 % de Ni) ou le 18/10, les métallurgistes s'accordent sur la caractéristique de « surface inoxydable » apportée par le chrome et la résistance mécanique à l'étirement et la résistance à la corrosion, apportées par le nickel. Au niveau des surfaces, il se forme un film d'oxydes protecteurs qui peut annihiler en grande partie les conditions favorables d'oxydation. ''A contrario'', en condition réductrice, et par exemple avec la dissémination de l'ion [[chlorure]] responsable de piqûres et de crevasses, la destruction de la couche d'oxydes peut être très rapide sous diverses contraintes, libérant les possibilités d'attaques plus profondes. |
|||
La microstructure des aciers spéciaux et super-alliages, observables en partie par les [[Cristallite|sous-grains et grains]], est tributaire de la déformation à chaud de l'acier ou de l'alliage. |
La microstructure des aciers spéciaux et super-alliages, observables en partie par les [[Cristallite|sous-grains et grains]], est tributaire de la déformation à chaud de l'acier ou de l'alliage. |
||
On le retrouve dans les |
On le retrouve dans les « bronzes au nickel » à base de 45 % à 67 % de Cu, de 19 % à 41 % Zn et de 10 % à 26 % Ni, avec des chouïas de Pb entre 0 % et 2,5 %, et 0,5 % de Mn et 0,5 % Fe, les alliages « nickel-bronze-aluminium » à base de Ni, Cu, Zn et Al, le packfong {{fchim|Cu|0,5|Ni|0,25|Zn|0,25}} ou les [[maillechort]]s, à base de Cu, Zn et Ni, qui ressemblent peu ou prou au métal argent, mais aussi l'argentan, l'[[argenton]], le [[ruolz]]{{etc.}} Des bijoux de faible prix sont ainsi fabriqués en alliage de nickel dit argenté. L'alliage nickel molybdène {{fchim|Ni|0,80|Mo|0,20}} est vendu en poudre, ces alliages à partir de {{fchim|Ni|0,5|Mo|0,5}} jusqu'à {{fchim|Ni|0,875|Mo|0,125}} ont été des modèles précoces pour l'étude de l'oxydation jusqu'à {{tmp|800|°C}}<ref>Marie-Josèphe Gouillon, ''[https://tel.archives-ouvertes.fr/tel-00880493/document Étude de la cinétique d'oxydation de l'alliage nickel-molybdène]'' (thèse), Génie des procédés, [[École nationale supérieure des mines de Saint-Étienne]], 1974.</ref>. |
||
Les propriétés thermiques et électriques justifient les alliages dénommés : [[invar]] à |
Les propriétés thermiques et électriques justifient les alliages dénommés : [[invar]] à 64 % de Fe et 36 % de Ni, [[constantan]] ([[Résistance (composant)|résistance]] de précision) de formule {{fchim|Cu|0,54|Ni|0,44|Mn|0,01|Fe|0,005|Zn|ε|Sn|έ}}, [[kovar]], platinite, [[alumel]], [[nimonic]] NiCrTiCoAl à environ 75 % Ni, [[cunife]], [[inconel]] ou incoloy DS, NiCrSi à l'origine des [[Composé intermétallique|alliages intermétalliques]]{{etc.}} Le [[coefficient de dilatation thermique]] de l'alliage {{fchim|Fe|0,53|Ni|0,29|Co|0,28}} est proche de celui du verre soufflé, il était utilisé comme conducteur dans les ampoules d'éclairage. |
||
Les propriétés magnétiques sont recherchées, par exemple le [[ |
Les propriétés magnétiques sont recherchées, par exemple le [[mu-métal]] qui tire sa dénomination de sa [[perméabilité magnétique]], l'[[Aimant AlNiCo|Alnico]] des aimants permanents. |
||
Le [[Nichrome|nickel-chrome]] est un [[alliage]] anti-corrosion et à résistance électrique |
Le [[Nichrome|nickel-chrome]] est un [[alliage]] anti-corrosion et à résistance électrique élevée. L'alliage karma {{fchim|Ni|0,74|Cr|0,20|Cu|0,03|Fe|0,03}} est un alliage spécifique de [[jauge de déformation]]. |
||
Les techniques électrochimiques nous ont laissé d'autres alliages de Ni, comme les [[Zinc allié|zincs alliés]]. Les procédés de vaporisation |
Les techniques électrochimiques nous ont laissé d'autres alliages de Ni, comme les [[Zinc allié|zincs alliés]]. Les procédés de vaporisation thermique (formant des dépôts limités à des couches fines) ou de métallurgie des poudres (en masse plus compacte) permettent de réaliser des alliages WNi, servant de cibles de pulvérisation pour revêtements électrochrome. Les alliages NiTi, comme l'alliage [[nitinol]], sont parmi les premiers reconnus [[Alliage à mémoire de forme|à mémoire de forme]]. L'alliage nickel-phosphore NiP peut constituer un matériau en réseau ultra-léger tridimensionnel de tubes creux de masse volumique avoisinant {{unité|0.9 mg/cm3}}<ref>[http://www.hrl.com/capabilities/caps_materials.html HRL laboratories primé par le ''Record Guinness''], d'après la brève du ''Monde'' {{nobr|§ 221}} du [http://us1.campaign-archive2.com/?u=14a11848e0c2bac1583ac67a5&id=1e13085a8e&e=9d3280aeb5 SCF Info en ligne, mars, {{Numéro avec majuscule|5}}].</ref>. |
||
== Chimie du nickel, corps composés et complexes à base de |
== Chimie du nickel, corps composés et complexes à base de nickel == |
||
Le nickel est moins réactif que le [[fer]] et le [[cobalt]], surtout vis à̠ vis des acides et de l'oxygène |
Le nickel est moins réactif que le [[fer]] et le [[cobalt]], surtout vis à̠ vis des acides et de l'oxygène{{note|groupe=Note|En dépit de leur réactivité décroissante, Fe, Co et Ni sont assez semblables d'un point de vue chimique. Le nickel, le palladium et le platine appartiennent au « groupe du nickel », le Pd et le Pt sont nettement moins réactifs que le nickel. Les trois métaux principaux du groupe sont des catalyseurs importants et forment un grand nombre de [[Complexe de coordination|complexes de coordination]].}}. |
||
À noter la valence 0 du [[Complexe (chimie)|complexe]] {{fchim|K|4|[Ni(CN)|4|]}} et du composé volatil [[tétracarbonyle de nickel]] {{fchim|Ni(CO)|4}}{{note|groupe=Note|La réaction réversible, pivot du [[procédé Mond]] qui permet de récupérer et/ou purifier le nickel, est la suivante : |
|||
: Ni {{ind|solide cristal}} + CO {{ind|gaz oxyde de carbone, réactif entre {{tmp|60|°C}} et {{tmp|80|°C}}}} → {{fchim|Ni(CO)|4 |
: Ni {{ind|solide cristal}} + 4 CO {{ind|gaz oxyde de carbone, réactif entre {{tmp|60|°C}} et {{tmp|80|°C}}}} → {{fchim|Ni(CO)|4}} {{ind|gaz qui se décompose vers {{tmp|180|°C}}}}. |
||
}}. |
|||
</ref>. |
|||
[[Fichier:Nickel(III) oxide powder.jpg|vignette|Poudre d'oxyde de nickel III|203x203px|gauche]] |
[[Fichier:Nickel(III) oxide powder.jpg|vignette|Poudre d'oxyde de nickel III.|203x203px|gauche]] |
||
Son nombre d'oxydation le plus commun est II, il atteste d'un caractère ionique<ref>Le nickel divalent est commun et stable, ce qui explique la vaste des composés de Ni(II). L'ion cobalt {{chem|Co{{exp|3+}}}} libre est très oxydant, sauf dans certains complexes stable. L'ion ferrique {{chem|fe{{exp|3+}}}} est un oxydant courant, plus modéré.</ref>. |
|||
Son [[nombre d'oxydation]] le plus commun est II, il atteste d'un caractère ionique{{note|groupe=Note|Le nickel [[divalent]] est commun et stable, ce qui explique le nombre élevé des composés de Ni(II). L'ion cobalt {{formule chimique|Co{{exp|3+}}}} libre est très oxydant, sauf dans certains complexes stables. L'[[ion ferrique]] {{formule chimique|Fe{{exp|3+}}}} est un oxydant courant, plus modéré.}}. |
|||
Il existe encore les degrés d'oxydation -II, -I, I, III, IV. Le [[degré d'oxydation]] III caractérisé par de nombreux complexes avec des ligands donneur pour la liaison σ-comme les familles des [[thiol]]s et des [[phosphine]]s, est minoritaire, tout comme le degré I, présent dans les alliages avec le sodium, les complexes tétraédriques bien stabilisé, et les enzymes à fonction d'hydrogénation (hydrogénases) et le IV, surtout communément préparé sous forme d'oxyde par les électrochimistes spécialisés dans les cathodes. Plus rares encore sont les degrés d'oxydation -II, -I.[[Fichier:Color of various Ni(II) complexes in aqueous solution.jpg|vignette|306x306px|La chimie colorée de l'ion Ni(II) en solutions aqueuses. De gauche à droite, complexe hexaammonié {{chem|[Ni(NH|3|)|6]|{{exp|2+}}}}, éthylène diaminé {{chem|[Ni([[Éthylènediamine|C{{ind|2}}H{{ind|4}}(NH{{ind|2}}){{ind|2}}]] ]|{{exp|2+}}}}, tétrachloré {{chem|[NiCl|4|]|{{exp|2-}}}} et cations hexahydratés {{chem|[Ni(H|2|O)|6|]|{{exp|2+}}}}.]] |
|||
Il existe les [[Nombre d'oxydation|degrés d'oxydation]] -II, -I, I, III, IV. Le degré d'{{nobr|oxydation III}}, caractérisé par de nombreux complexes avec des [[Ligand (chimie)|ligands]] donneurs pour la {{lnobr|liaison σ}}, comme les familles des [[thiol]]s et des [[phosphine]]s, est minoritaire, tout comme le {{nobr|degré I}}, présent dans les alliages avec le sodium, les complexes tétraédriques bien stabilisés, et les enzymes à fonction d'hydrogénation ([[hydrogénase]]s) et le IV, surtout communément préparé sous forme d'oxyde par les [[Électrochimie|électrochimistes]] spécialisés dans les [[cathode]]s. Plus rares encore sont les degrés d'{{nobr|oxydation -II}}, -I. |
|||
Les sels de nickel sont souvent isomorphes de ceux du fer. Il existe une vaste gamme de sels doubles, diversement hydratés, avec les métaux alcalins et le cation [[ammonium]]. Ainsi {{fchim|NiSO|4|.(NH|4|)|2|SO|4|. 6 H|2|O }}... Ils sont très souvent isomorphes des sels doubles où le nickel(II) est remplacé par l'ion fer, cobalt, magnésium... ions métalliques divalents. |
|||
[[Fichier:Color of various Ni(II) complexes in aqueous solution.jpg|vignette|La chimie colorée de l'ion Ni(II) en solutions aqueuses. De gauche à droite, complexe hexaammonié {{formule chimique|[Ni(NH|3|)|6|]{{exp|2+}}}}, [[Éthylènediamine|éthylène diaminé]] {{formule chimique|[Ni([[Éthylènediamine|NH{{ind|2}}CH{{ind|2}}CH{{ind|2}}NH{{ind|2}}]])]{{exp|2+}}}}, tétrachloré {{formule chimique|[NiCl|4|]{{exp|2−}}}} et cations hexa[[Hydrate|hydratés]] {{formule chimique|[Ni(H|2|O)|6|]{{exp|2+}}}}.]] |
|||
Un grand nombre de sel de nickel divalent, une fois dissous dans l'eau, a la couleur vert-pomme de l'ion hydraté {{chem|[Ni(H|2|O)|6|]|{{exp|2+}}}}, tout comme les cristaux hydratés de différents sels de nickel. Anhydres, ils sont plutôt jaune ou à nuance de vert plus faible. La couleur dépend toutefois de l'anion, à la fois de son électronégativité et de sa polarisabilité, ainsi {{fchim|NiBr|2|}} est jaune alors que {{fchim|NiI|2|}} est noir. Dissous dans l'[[ammoniaque]], la coloration des solutions est bleue ou violette, grâce aux ions complexes du nickel ammoniacal {{fchim|[Ni(NH|3|)|n|]{{exp|2+}}}}. |
|||
Les sels de nickel sont souvent isomorphes de ceux du fer. Il existe une vaste gamme de sels doubles, diversement hydratés, avec les métaux alcalins et le cation [[ammonium]]. Ainsi {{fchim|NiSO|4|.(NH|4|)|2|SO|4|. 6 H|2|O}}… Ils sont très souvent isomorphes des sels doubles où le nickel(II) est remplacé par l'ion fer, cobalt, magnésium{{etc.}}, ions métalliques divalents. |
|||
Un grand nombre de sel de nickel divalent, une fois dissous dans l'eau, a la couleur vert-pomme de l'ion hydraté {{formule chimique|[Ni(H|2|O)|6|]{{exp|2+}}}}, tout comme les cristaux hydratés de différents sels de nickel. Anhydres, ils sont plutôt jaune ou à nuance de vert plus faible. La couleur dépend toutefois de l'anion, à la fois de son électronégativité et de sa polarisabilité, ainsi {{fchim|NiBr|2}} est jaune alors que {{fchim|NiI|2}} est noir. Dissous dans l'[[ammoniaque]], la coloration des solutions est bleue ou violette, grâce aux ions complexes du nickel ammoniacal {{fchim|[Ni(NH|3|)|{{mvar|n}}|]{{exp|2+}}}}. |
|||
La chimie du nickel est marquée par les complexes colorés de Ni(II) avec des configurations électroniques suivant la théorie des ligands ou champ de coordination. Leurs structures peuvent être selon l'hybridation : |
La chimie du nickel est marquée par les complexes colorés de Ni(II) avec des configurations électroniques suivant la théorie des ligands ou champ de coordination. Leurs structures peuvent être selon l'hybridation : |
||
* dsp{{exp|2}} en plan-carré, à comportement diamagnétique et le plus souvent rouge, brun, jaune, par exemple {{ |
* dsp{{exp|2}} en plan-carré, à comportement [[Diamagnétisme|diamagnétique]] et le plus souvent rouge, brun, jaune, par exemple {{formule chimique|[Ni(CN)|4|]{{exp|2−}}}} ; |
||
* sp{{exp|3}} tétraédrique, paramagnétique, le plus souvent bleu ou vert, par exemple {{ |
* sp{{exp|3}} tétraédrique, [[Paramagnétisme|paramagnétique]], le plus souvent bleu ou vert, par exemple {{formule chimique|[Ni(Cl)|4|]{{exp|2−}}}} ; |
||
* sp{{exp|3}}d{{exp|2}} octaédrique, par exemple {{ |
* sp{{exp|3}}d{{exp|2}} octaédrique, par exemple {{formule chimique|[Ni(H|2|O)|6|]{{exp|2+}}}} ou {{fchim|[Ni(NH|3|)|6|]{{exp|2+}}}}. |
||
Les complexes de Ni(II) sont difficilement oxydables en complexes de Ni(III), au contraire des ions et complexes de cobalt et de fer |
Les complexes de Ni(II) sont difficilement oxydables en complexes de Ni(III), au contraire des ions et complexes de cobalt et de fer{{note|groupe=Note|{{formule chimique|[Fe{{exp|II}}(CN)|6|]{{exp|4−}}}} peut être oxydé facilement en {{formule chimique|[Fe{{exp|III}}(CN)|6|]{{exp|3−}}}}.}}. Les complexes de Ni(II) peuvent être facilement réduits en Ni(I) voire en Ni(0). Ainsi le complexe cyanuré {{formule chimique|[Ni(CN)|4|]{{exp|2−}}}} peut être réduit en {{formule chimique|[Ni(CN)|3|]{{exp|2−}}}}, voire en {{formule chimique|[Ni(CN)|4|]{{exp|4−}}}}. |
||
Le cyanure de nickel qui cristallise dans un mélange ammoniac-benzène laisse un cyanure de nickel ammino-benzénique. Tout se passe comme si les molécules de benzène, sans être |
Le cyanure de nickel qui cristallise dans un mélange ammoniac-benzène laisse un cyanure de nickel ammino-benzénique. Tout se passe comme si les molécules de benzène, sans être liées, étaient captées dans les mailles du réseau cristallin formé. Ces complexes sont nommés « [[clathrate]]s ». |
||
L'ion nickel, comme l'ion vanadium, se retrouve aussi piégé dans les structures [[Chimie supramoléculaire| |
L'ion nickel, comme l'ion vanadium, se retrouve aussi piégé dans les structures [[Chimie supramoléculaire|supramoléculaires]] de type [[porphyrine]], par exemple au sein des fractions lourdes de [[pétrole brut]]. |
||
Il est possible de fabriquer de la |
Il est possible de fabriquer de la « fonte au nickel » ou du « métal carburé ». |
||
: Ni {{ind|solide cristal}} + C{{ind|charbon de bois après chauffage}} → {{fchim|Ni|1-x|C| |
: Ni {{ind|solide cristal}} + C{{ind|charbon de bois après chauffage}} → {{fchim|Ni|1-{{mvar|x}}|C|{{mvar|x}}}} {{ind|« fonte au nickel » avec {{mvar|x}} fraction de plusieurs pourcents}} |
||
L'oxyde de nickel était réduit directement dans un creuset brasqué au feu de forge. |
L'oxyde de nickel était réduit directement dans un creuset brasqué au feu de forge. |
||
: NiO {{ind|solide cristal}} + C{{ind|charbon de bois après chauffage}} → |
: NiO {{ind|solide cristal}} + C{{ind|charbon de bois après chauffage}} → NiC {{ind|« métal nickel carburé fondu »}} + CO{{ind|gaz}} |
||
Le nickel réagit à chaud avec les corps oxydants, comme le gaz [[Dioxygène|oxygène]] ou les [[halogène]]s, comme le [[Dichlore|chlore]]. |
|||
[[Fichier:Nickel(II)-hydroxid.jpg|vignette|redresse=.5|Précipité d'hydroxyde de nickel II.]] |
|||
Le nickel est [[chalcophile]] et arsénophile. Il réagit facilement avec le [[soufre]] et l'[[arsenic]]. |
|||
Le nickel réagit à chaud avec les corps oxydants, comme le gaz [[Dioxygène|oxygène]] ou les [[halogène]]s, comme le [[Dichlore|chlore]].[[Fichier:Nickel(II)-hydroxid.jpg|vignette|248x248px|Précipité d'hydroxyde de nickel II]]Le nickel est [[chalcophile]] et arsénophile. Il réagit facilement avec le [[soufre]] et l'[[arsenic]]. |
|||
=== Principaux composés === |
=== Principaux composés === |
||
Parmi les principaux composés, |
Parmi les principaux composés, on peut citer : |
||
* Oxydes de nickel et oxydes mixtes |
* Oxydes de nickel et oxydes mixtes |
||
: |
: Protoxyde ou [[Oxyde de nickel(II)|monoxyde de nickel(II)]] NiO |
||
: [[Oxyde de nickel(III)| |
: [[Oxyde de nickel(III)|Sesquioxyde de nickel]] {{fchim|Ni|2|O|3}} non basique et instable à la chaleur |
||
: |
: Oxyde magnétique {{fchim|Ni|3|O|4}} |
||
: [[Oxyde de nickel(IV)| |
: [[Oxyde de nickel(IV)|Dioxyde de nickel]] {{fchim|NiO|2}} |
||
: [[Ferrite (céramique ferromagnétique)| |
: [[Ferrite (céramique ferromagnétique)|Ferrites]] au nickel {{fchim|Ni|1-{{mvar|x}}|Zn|{{mvar|x}}|Fe|2|O|4}} |
||
* Oxyhydroxydes de nickel |
* Oxyhydroxydes de nickel |
||
: [[Oxyhydroxyde de nickel]] |
: [[Oxyhydroxyde de nickel]] NiOOH |
||
: Autres |
: Autres oxyhydroxydes de Ni(III) {{fchim|Ni|2|O|3|. {{mvar|n}} H|2|O}} |
||
: Autres |
: Autres oxyhydroxydes de Ni(IV) {{fchim|NiO|2|. {{mvar|n}} H|2|O}} des batteries d'Edison |
||
* Hydroxydes de nickel |
* Hydroxydes de nickel |
||
: [[Hydroxyde de nickel(II)| |
: [[Hydroxyde de nickel(II)|Hydroxyde de nickel]] {{fchim|Ni(OH)|2}} |
||
: |
: Hydroxyde de nickel hydraté {{fchim|Ni(OH)|2|. {{frac|1|4}} H|2|O}} |
||
: Hydroxyde de nickel III {{fchim|Ni |
: Hydroxyde de nickel III {{fchim|Ni(OH)|3}} |
||
* Fluorures de nickel |
* Fluorures de nickel |
||
: [[Fluorure de nickel(II)|Fluorure de nickel]] {{fchim| |
: [[Fluorure de nickel(II)|Fluorure de nickel]] {{fchim|NiF|2}} |
||
: [[ |
: [[Hexafluoronickélate(IV) de potassium]] {{fchim|K|2|[NiF|6|]}} instable |
||
[[Fichier:Anhydrous Nickel(II)-chloride.jpg|vignette|Chlorure de nickel|165x165px]] |
|||
[[Fichier:Anhydrous Nickel(II)-chloride.jpg|vignette|Chlorure de nickel.|165x165px]] |
|||
* Chlorures de nickel |
* Chlorures de nickel |
||
: [[Chlorure de nickel(II)|Chlorure de nickel divalent]] {{fchim| |
: [[Chlorure de nickel(II)|Chlorure de nickel divalent]] {{fchim|NiCl|2}} jaune |
||
: Hexahydrate de chlorure de nickel {{fchim| |
: Hexahydrate de chlorure de nickel {{fchim|NiCl|2|. 6 H|2|O}} aux cristaux vert-émeraude |
||
[[Fichier:Nickel(II)-chloride-hexahydrate-sample.jpg|vignette|Hexahydrate de chlorure de nickel|164x164px]] |
|||
[[Fichier:Nickel(II)-chloride-hexahydrate-sample.jpg|vignette|Hexahydrate de chlorure de nickel.|164x164px]] |
|||
: chlorure de nickel hexa-ammonié {{fchim|Ni||Cl|2|. 6 NH|3|}} |
|||
: Ammonio-chlorure de nickel {{fchim|Ni||Cl|2|. NH|4|Cl. 6 H|2|O }} |
|||
: Chlorure de nickel hexa-ammonié {{fchim|NiCl|2|. 6 NH|3}} |
|||
: Ammonio-chlorure de nickel {{fchim|NiCl|2|. NH|4|Cl. 6 H|2|O}} |
|||
* Bromures de nickel |
* Bromures de nickel |
||
: {{fchim| |
: {{fchim|NiBr|2}}, corps brun-jaune déliquescent |
||
: {{fchim| |
: {{fchim|NiBr|2|. 3 H|2|O}} |
||
: {{fchim| |
: {{fchim|NiBr|2|. 6 NH|3}}, poudre violette |
||
[[Fichier:Nickel hexammine bromide.jpg|vignette|Bromure de nickel(II) hexammonié |158x158px]] |
|||
[[Fichier:Nickel hexammine bromide.jpg|vignette|Bromure de nickel(II) hexammonié.|158x158px]] |
|||
: bromoplatinate de nickel {{fchim|NiPtBr|6|. 6 H|2|O}} |
|||
: Bromoplatinate de nickel {{fchim|NiPtBr|6|. 6 H|2|O}} |
|||
* Iodures de nickel |
* Iodures de nickel |
||
: [[Iodure de nickel(II)| |
: [[Iodure de nickel(II)|Iodure de nickel]] {{fchim|NiI|2}} noir |
||
* Antimoniures de nickel |
* Antimoniures de nickel |
||
: {{ |
: NiSb{{note|groupe=Note|''Magnetic dependent resistor'' (MDR).}} |
||
* Sulfures de nickel |
* Sulfures de nickel |
||
: [[Sulfure de nickel]] |
: [[Sulfure de nickel]] NiS noir |
||
: |
: Sous-sulfure de nickel {{fchim|Ni|3|S|2}} |
||
: |
: Sulfure de fer et de nickel |
||
* Arséniures de nickel |
* Arséniures de nickel |
||
: |
: NiAs ou [[nickéline]] |
||
: [[Nickelskuttérudite|Nickel-skuttérudite]], [[cristal]] de formule chimique (Ni,Co) As 2 à 3 |
: [[Nickelskuttérudite|Nickel-skuttérudite]], [[cristal]] de formule chimique (Ni,Co) As 2 à 3{{note|groupe=Note|Espèce découverte en 1845, classe chimique des sulfures.}} |
||
[[Fichier:Nickel sulfate hydrate.jpg|vignette|Sulfate de nickel hexahydraté|149x149px]] |
|||
[[Fichier:Nickel sulfate hydrate.jpg|vignette|Sulfate de nickel hexahydraté.|149x149px]] |
|||
* Sulfo-antimoniures de Ni |
|||
* Sulfo-arséniures de Ni |
|||
* Sulfo-antimoniures de nickel |
|||
* Sulfo-arséniures de nickel |
|||
* Sulfates de nickel |
* Sulfates de nickel |
||
[[Fichier:Nickel(II) nitrate.jpg|vignette|Cristaux de nitrate de nickel|139x139px]] |
|||
[[Fichier:Nickel(II) nitrate.jpg|vignette|Cristaux de nitrate de nickel.|139x139px]] |
|||
: [[Sulfate de nickel(II)|Sulfate de nickel]] |
: [[Sulfate de nickel(II)|Sulfate de nickel]] |
||
: |
: Sulfate de nickel hydraté |
||
: |
: Sulfate double de nickel et d'ammonium hexahydraté {{fchim|NiSO|4|(NH|4|)|2|SO|4|. 6 H|2|O}} |
||
: [[Nickel-boussingaultite]], minéral de formule chimique (NH4){{ind|2}} (Ni,Mg) (SO{{ind|4}}){{ind|2}}, 6 H{{ind|2}}O |
: [[Nickel-boussingaultite]], minéral de formule chimique (NH4){{ind|2}} (Ni,Mg) (SO{{ind|4}}){{ind|2}}, 6 H{{ind|2}}O{{note|groupe=Note|Classe chimique : sulfates, espèce découverte en 1976.}} |
||
* Urano-sulfates de nickel |
* Urano-sulfates de nickel |
||
: [[Nickel-zippeite]], minéral de formule chimique Ni{{ind|2}}(UO{{ind|2}}){{ind|6}}(SO{{ind|4}}){{ind|3}}(OH){{ind|10}},16 H{{ind|2}}O |
: [[Nickel-zippeite]], minéral de formule chimique Ni{{ind|2}}(UO{{ind|2}}){{ind|6}}(SO{{ind|4}}){{ind|3}}(OH){{ind|10}},16 H{{ind|2}}O{{note|groupe=Note|Espèce minérale découverte en 1976, classe chimique : sulfates.}} |
||
* Carbonates de nickel |
* Carbonates de nickel |
||
[[Fichier:Basic-nickel(II)-carbonate.jpg|vignette|129x129px|Carbonate de nickel basique]] |
|||
[[Fichier:Basic-nickel(II)-carbonate.jpg|vignette|129x129px|Carbonate de nickel basique.]] |
|||
: {{fchim|Ni||CO|3|}} |
|||
: Hydroxycarbonate x NiCO3 • y Ni(OH)2 • z {{fchim|H|2|O}} |
|||
: {{fchim|NiCO|3}} |
|||
: Hydroxycarbonates {{mvar|x}} NiCO3 • {{mvar|y}} Ni(OH)2 • {{mvar|z}} {{H2O}} |
|||
* Nitrates de nickel |
* Nitrates de nickel |
||
* Phosphates de nickel |
* Phosphates de nickel |
||
[[Fichier:Nickel Phosphate n-Hydrate.jpg|vignette|186x186px|Cristaux de phosphate de nickel vert.]] |
[[Fichier:Nickel Phosphate n-Hydrate.jpg|vignette|186x186px|Cristaux de phosphate de nickel vert.]] |
||
* borates de nickel |
|||
* Borates de nickel |
|||
: borate de nickel(II) {{fchim|Ni(BO|2|)|2|}}<ref>catalyseur</ref> |
|||
: Borate de nickel(II) {{fchim|Ni(BO|2|)|2}}{{note|groupe=Note|Catalyseur.}} |
|||
* Sulfamate de nickel |
* Sulfamate de nickel |
||
* Chlorates de nickel |
* Chlorates de nickel |
||
| Ligne 249 : | Ligne 283 : | ||
* Arséniates de nickel |
* Arséniates de nickel |
||
* Hydrures de nickel |
* Hydrures de nickel |
||
: [[ |
: [[Hydrure de nickel]] |
||
[[Fichier:Nickel(II)-cyanid.jpg|vignette|268x268px|Précipité de cyanure de nickel.]] |
|||
* [[Phosphure de nickel|Phosphures de nickel]] |
* [[Phosphure de nickel|Phosphures de nickel]] |
||
* |
* Cyanures de nickel |
||
: |
: Cyanure de nickel(II) {{fchim|Ni(CN)|2}} |
||
: |
: Complexe de Ni(I) {{fchim|K|2|[Ni(CN)|3]}} le plus souvent dimérisé |
||
: |
: Complexe de Ni(O) {{fchim|K|4|[Ni(CN)|4]}} |
||
: |
: Cyanure de nickel ammino-benzénique, « complexe [[clathrate]] » |
||
* Glyoximes |
* Glyoximes |
||
: |
: Bis-diméthyl-glyoxime de nickel {{fchim|NiC|8|H|14|O|4|N|4}}, cristaux rouge écarlate, « complexe [[chélate]] » insoluble dans l'eau |
||
[[Fichier:Nickel-Diacetyldioxim.jpg|vignette|266x266px|Précipitation de Nickel-Diacétyle-dioxime]] |
|||
[[Fichier:Nickel-Diacetyldioxim.jpg|vignette|266x266px|Précipitation de nickel-diacétyle-dioxime.]] |
|||
: Diacétyl-glyoxime de nickel |
: Diacétyl-glyoxime de nickel |
||
[[Fichier:Nickel Dimethylglyoxime 2014.05.08.jpg|vignette|Formation de précipité de bis-diméthyl-glyoxime de Ni dans des solutions légèrement ammoniacales]] |
|||
[[Fichier:Nickel Dimethylglyoxime 2014.05.08.jpg|vignette|Formation de précipité de bis-diméthyl-glyoxime de Ni dans des solutions légèrement ammoniacales.]] |
|||
* Nickel-carbonyle ou nickel-tétracarbonyle {{fchim|Ni(CO)|4|}} |
|||
* Nitroso-carbonyle de nickel {{fchim|Ni(CO)|2|(NO)|2|}} |
|||
* Nickel carbonyle ou [[tétracarbonyle de nickel]] {{fchim|Ni(CO)|4}} |
|||
Il existe aussi des composés organo-nickéliques mieux stabilisés |
|||
* Nitroso-carbonyle de nickel {{fchim|Ni(CO)|2|(NO)|2}} |
|||
* Bis(cyclopentadiényl)nickel (II)) ou [[Nickelocène]] |
|||
Il existe aussi des composés organo-nickéliques mieux stabilisés : |
|||
* [[Bis(1,5-cyclooctadiène)nickel]] |
|||
* bis(cyclopentadiényl)nickel (II)) ou [[nickelocène]] ; |
|||
* [[bis(1,5-cyclooctadiène)nickel]]. |
|||
=== Analyse === |
=== Analyse === |
||
Le nickel colore la perle de [[borax]] en jaune pâle à froid, en rouge orange à chaud. |
Le nickel colore la perle de [[borax]] en jaune pâle à froid, en rouge orange à chaud. |
||
L'analyse quantitative peut utiliser la |
L'analyse quantitative peut utiliser la [[diméthylglyoxime]], ou « réactif de [[Tschugaeff]] » : le cation nickel divalent réagit avec la diméthylglyoxime pour donner un composé électriquement neutre, [[chélate]] rouge ou écarlate, le bis(diméthylglyoxime) de nickel{{note|groupe=Note|Ce composé structuré en cycle est un chélate. La [[chélation]], en particulier par les [[liaisons hydrogène]], stabilise les complexes.}}. Ce complexe important, en analyse qualitative et quantitative du nickel, précipite dans des solutions légèrement ammoniacales. |
||
== Utilisations == |
== Utilisations == |
||
Le nickel extrait est utilisé pour produire des [[Acier inoxydable|aciers inoxydables]] (à hauteur de 68 % du tonnage) des alliages non ferreux (10 %), [[nickelage électrolytique]] (9 %), alliages d'acier (7 %), en fonderie (3 %) et enfin pour d'autres usages dont les accumulateurs (4 %)<ref name=UseInSociety>{{lien web|lang=en|url=https://www.nickelinstitute.org/NickelUseInSociety/AboutNickel/FirstAndEndUsesofNickel.aspx|titre=Nickel Use In Society|website=Nickel Institute|archive-url=https://web.archive.org/web/20170921000402/https://www.nickelinstitute.org/NickelUseInSociety/AboutNickel/FirstAndEndUsesofNickel.aspx|archive-date=21 septembre 2017}}.</ref>. Environ 27 % de toute la production de nickel est utilisée pour l'ingénierie, 10 % pour la construction, 14 % pour les produits tubulaires, 20 % pour les produits métalliques, 14 % pour le transport, 11 % pour les produits électroniques et 5 % pour d'autres usages<ref name=UseInSociety/>. |
|||
Le nickel extrait est utilisé pour produire des [[Acier inoxydable|aciers inoxydables]] (à hauteur de 68% du tonnage) des alliages non ferreux (10%), [[nickelage électrolytique]] (9%), alliages d'acier (7%), en fonderie (3%) et enfin pour d'autres usages dont les accumulateurs (4%)<ref>{{lien web|lang=en|url=https://www.nickelinstitute.org/NickelUseInSociety/AboutNickel/FirstAndEndUsesofNickel.aspx|titre=Nickel Use In Society|website=Nickel Institute|archive-url=https://web.archive.org/web/20170921000402/https://www.nickelinstitute.org/NickelUseInSociety/AboutNickel/FirstAndEndUsesofNickel.aspx|archive-date=21 septembre 2017}}</ref> |
|||
=== Alliages === |
=== Alliages === |
||
Le nickel entre dans la composition de plusieurs familles d'[[alliage]]s métalliques. En dehors des [[Acier inoxydable|aciers inoxydables]] (qui n'appartiennent pas à la famille des alliages de nickel mais à celle des aciers), les alliages de nickel peuvent être classés en trois catégories : |
Le nickel entre dans la composition de plusieurs familles d'[[alliage]]s métalliques. En dehors des [[Acier inoxydable|aciers inoxydables]] (qui n'appartiennent pas à la famille des alliages de nickel mais à celle des aciers), les alliages de nickel peuvent être classés en trois catégories : |
||
* |
* les alliages [[fer]]-nickel : ils sont utilisés pour leurs propriétés physiques, parfois étonnantes. Par exemple, l'[[invar]], alliage fer-nickel contenant 36 % de nickel (FeNi36), est quasiment non dilatable en dessous de {{tmp|200|°C}}. Il y est utilisé en [[cryogénie]] (cuve des navires méthaniers), en physique des lasers (éléments de structure) ou dans les écrans de téléviseurs cathodiques ([[shadow mask]]). Les propriétés physiques des alliages fer-nickel mises à profit sont les propriétés [[Magnétisme|magnétiques]] ([[mu-métal]], alliages à forte [[perméabilité magnétique]], alliages à bas [[Température de Curie|point de Curie]], alliages [[Magnétostriction|magnétostrictifs]]), élastiques (alliages à très faible coefficient thermoélastique), ainsi que leurs extraordinaires propriétés de [[dilatation thermique|dilatation]] (alliages non dilatables ou à dilatation contrôlée) ; |
||
* |
* les alliages [[cuivre]]-nickel (cupro-nickels) : ils présentent une très bonne résistance à la [[corrosion]] en milieu acide ou marin, ainsi qu'une bonne aptitude à la mise en forme et au soudage ; |
||
* |
* les [[superalliage]]s : c'est ainsi qu'on appelle une famille d'alliages de composition complexe, à base de nickel (ou de [[cobalt]]), comme le [[nichrome]], présentant une excellente résistance à la [[corrosion sèche]] à haute température et de très bonnes propriétés mécaniques ([[limite d'élasticité]] élevée, résistance au [[fluage]]). Ce sont des matériaux de choix pour les [[turboréacteur]]s ([[aéronautique]]) et certaines chaudières. Le développement de ces alliages a accompagné celui des moteurs d'avion depuis le milieu du {{s-|XX}}. La série des [[Nimonic]], résistante aux fortes pressions et aux hautes températures, sert en particulier à fabriquer des [[Turbine à gaz|turbines à gaz]] et des réacteurs. |
||
Le nickel est souvent présent dans les aciers spéciaux. Les aciers au Ni et Cr servent à fabriquer des plaques |
Le nickel est souvent présent dans les aciers spéciaux. Les aciers au Ni et Cr servent à fabriquer des plaques blindées, des coffres-forts et portes blindées, des chars d'assaut{{etc.}} Le [[Nichrome|nickel-chrome]] est utilisé comme résistance chauffante {{fchim|Ni|60 à 80 %|Cr|10 à 25 %|Fe|ε|Mn|έ}}, mais aussi en particulier pour les soins dentaires et comme matériau de soudure<ref>{{lien brisé|consulté le=2013-03-25|url=http://www.atlantic-codental.com/rp2.htm}}.</ref>. |
||
[[Fichier:Nickel(II) oxide catalyst.jpg|vignette|265x265px|Catalyseur NiO/TiO{{ind|2}}-SiO{{ind|2}}]] |
|||
[[Fichier:Nickel(II) oxide catalyst.jpg|vignette|265x265px|Catalyseur NiO/TiO{{ind|2}}-SiO{{ind|2}}.]] |
|||
En [[Joaillerie|bijouterie]], on associe le nickel à l’[[or]] afin d'obtenir une meilleure tenue mécanique ainsi que des couleurs originales. Ainsi, du [[cuivre]], du nickel et de l’[[or]] donnent de l’or jaune ou rosé. L’or et le nickel donnent de l’or blanc. Les "bronzes au nickel" se retrouve dans les profilés pour architecture ou élément de décoration et dans les couverts des services de table, en petite bijouterie avec les alliages alpacca, mais aussi dans les instruments de dessin industriels (compas, pinte-sèche...), les mécanismes d'horlogerie comme les ressorts, les pièces de précision de l'instrumentation scientifique et technique, divers composants de mécanique de précision et d'optique, . |
|||
En [[Joaillerie|bijouterie]], on associe le nickel à l’[[or]] afin d'obtenir une meilleure tenue mécanique ainsi que des couleurs originales. Ainsi, du [[cuivre]], du nickel et de l’or donnent de l’or jaune ou rosé. L’or et le nickel donnent de l’or blanc. Les « bronzes au nickel » se retrouvent dans les profilés pour architecture ou élément de décoration et dans les couverts des services de table, en petite bijouterie avec les alliages [[Maillechort|alpacca]], mais aussi dans les instruments de dessin industriels ([[Compas (géométrie)|compas]], [[pointe sèche]]…), les mécanismes d'horlogerie comme les ressorts, les pièces de précision de l'instrumentation scientifique et technique, divers composants de [[mécanique de précision]] et d'optique. |
|||
=== Autres usages === |
|||
=== Autres usages === |
|||
Le nickelage est le plus souvent un revêtement anti-corrosion, obtenu par placage électrolytique à l'aide de sels hydrosolubles. Il est très utile sur le fer, métal plus sensible à la corrosion. |
Le nickelage est le plus souvent un revêtement anti-corrosion, obtenu par placage électrolytique à l'aide de sels hydrosolubles. Il est très utile sur le fer, métal plus sensible à la corrosion. |
||
Un débouché « historique » du nickel sont les pièces de monnaie, où les qualités de malléabilité et de résistance du produit, à faible usure, sont particulièrement appréciées. Ainsi, on trouve du nickel dans les pièces américaines, canadiennes et dans les pièces d'un et de deux [[ |
Un débouché « historique » du nickel sont les pièces de monnaie, où les qualités de malléabilité et de résistance du produit, à faible usure, sont particulièrement appréciées. Ainsi, on trouve du nickel dans les pièces américaines, canadiennes et dans les pièces d'un et de deux [[euro]]s. Les pièces de nickel pur ou à revêtement de nickel sont blanches, les pièces en cupronickel sont jaunes. |
||
Le nickel sert à fabriquer des aimants, des écrans magnétiques. Il sert à fabriquer des contacteurs électriques et des électrodes, des bougies de moteurs à explosion. Il est utilisé comme résistance chauffante (grille |
Le nickel sert à fabriquer des aimants, des écrans magnétiques. Il sert à fabriquer des contacteurs électriques et des électrodes, des bougies de moteurs à combustion et explosion. Il est utilisé comme résistance chauffante (grille-pain, radiateur ou encore sèche-cheveux) grâce à son coefficient de conductibilité thermique très faible, ou comme revêtement sur les [[Casque F1|casques F1]] des [[Pompier|sapeurs pompiers]]. |
||
Le nickel sert à fabriquer des spatules, des creusets et divers instruments pour analyse. Des cuves de nickel sont employées pour le transport sur les navires de soude caustique, concentrée ou très pure. Il sert au raffinage et au stockage des solvants chlorés ou de divers composés, comme le [[Phénol (molécule)|phénol]]. Sa surface propre évite aussi toute contamination ou décoloration de ces matières. Le nickel pur est utilisé pour certains types de cordes de guitare électrique. |
Le nickel sert à fabriquer des spatules, des creusets et divers instruments pour analyse. Des cuves de nickel sont employées pour le transport sur les navires de soude caustique, concentrée ou très pure. Il sert au raffinage et au stockage des solvants chlorés ou de divers composés, comme le [[Phénol (molécule)|phénol]]. Sa surface propre évite aussi toute contamination ou décoloration de ces matières. Le nickel pur est utilisé pour certains types de cordes de guitare électrique. |
||
=== Accumulateurs === |
=== Accumulateurs === |
||
Le nickel est aussi utilisé dans divers [[Accumulateur électrique|accumulateurs]] alcalins, type fer-nickel, nickel-cadmium{{etc.}}, ou autres. Par exemple, il constitue la [[cathode]] des [[Pile alcaline|piles alcalines]] nickel-[[dioxyde de manganèse]], et des accumulateurs alcalins nickel-cadmium, nickel-métal [[hydrure]] et nickel-zinc. |
|||
Le nickel est aussi utilisé dans divers accumulateurs alcalins, type fer-nickel, nickel-cadmium... ou autres. Par exemple il constitue la [[cathode]] des [[pile électrique|piles alcalines]] nickel-[[dioxyde de manganèse]], et des [[Accumulateur électrique|accumulateurs]] alcalins nickel-[[cadmium]], nickel-métal [[hydrure]] et nickel-[[zinc]]. |
|||
=== Catalyse et photochimie === |
=== Catalyse et photochimie === |
||
[[Fichier:Dry Raney nickel.jpg|gauche|vignette|198x198px|Ni de Raney, poudre grise, sur une coupelle, dans une « chambre à gants » dûment inertée.]] |
|||
[[Fichier:Close-up of Raney nickel.png|vignette|Surface de Ni Raney en microscopie électronique.|200x200px|gauche]] |
|||
En dehors de son rôle d'élément d'alliage et de partie d'accumulateurs, le nickel est également utilisé comme catalyseur d'[[hydrogénation]]. Les catalyseurs à base de nickel sont utilisés pour hydrogéner les [[Acide gras insaturé|corps gras insaturés]], pour fabriquer de la [[margarine]] ou certains [[savon]]s par exemple. |
|||
Le [[nickel de Raney]] ou le nickel de Sabatier-Senderens catalysent l'hydrogénation. La « mousse de nickel » joue ce rôle. |
|||
En dehors de son rôle d'élément d'alliage et de partie d'accumulateurs, le nickel est également utilisé comme catalyseur d'[[hydrogénation]]. Les catalyseurs à base de Ni est utilisé pour hydrogéner les [[Acide gras insaturé|corps gras insaturés]], pour fabriquer de la [[margarine]] ou certains [[savon]]s par exemple. |
|||
[[Fichier:Dry Raney nickel.jpg|gauche|vignette|198x198px|Ni de Raney, poudre grise, sur une coupelle, dans une "chambre à gants" dûment inertée]] |
|||
[[Fichier:Close-up of Raney nickel.png|vignette|Surface de Ni Raney en microscopie électronique|200x200px|gauche]] |
|||
Le [[nickel de Raney]] ou le nickel de Sabatier-Senderens catalysent l'[[hydrogénation]]. La "mousse de nickel" joue ce rôle. |
|||
Certains complexes de Ni(II), comme les thiophénolates alkyl-aminés, jouent un rôle stabilisant vis-à-vis de la lumière, ils sont nommés [[désactivateur]]s ou |
Certains complexes de Ni(II), comme les thiophénolates alkyl-aminés, jouent un rôle stabilisant vis-à-vis de la lumière, ils sont nommés « [[désactivateur]]s » ou « ''{{Langue|en|texte=[[quencher]]s}}'' » en anglais scientifique{{note|groupe=Note|En référence au verbe ''{{Langue|en|texte=to quench}}'', éteindre. Par exemple, le butylaminethiophénolate de Ni(II).}}. Insérés dans les parties [[chromophore]]s d'un [[polymère]], ces centres jouent un rôle dans le [[stockage de l'énergie]], qui peut être ensuite libérée par la [[Chaleur (thermodynamique)|chaleur]], la [[fluorescence]] et/ou la [[phosphorescence]]. |
||
En chimie [[radicalaire]], les complexes de Ni(II) tels que les dialkylthiocarbamates, les thiobisphénolates et autres phosphites, sont des désactivateurs d'hydroxy-peroxydes et des piégeurs efficaces de radicaux libres. Ils peuvent stopper une réaction radicalaire, suffisamment lente. |
En chimie [[radicalaire]], les complexes de Ni(II) tels que les dialkylthiocarbamates, les thiobisphénolates et autres phosphites, sont des désactivateurs d'hydroxy-peroxydes et des piégeurs efficaces de radicaux libres. Ils peuvent stopper une réaction radicalaire, suffisamment lente. |
||
| Ligne 316 : | Ligne 353 : | ||
Ni est un ion actif dans certaines [[enzyme]]s qui utilisent du nickel comme centre catalytique. |
Ni est un ion actif dans certaines [[enzyme]]s qui utilisent du nickel comme centre catalytique. |
||
Les [[sel (chimie)|sels]] de nickel (hydroxycarbonate, chlorure, sulfate, hypophosphite. |
Les [[sel (chimie)|sels]] de nickel (hydroxycarbonate, chlorure, sulfate, hypophosphite{{etc.}}) ne sont seulement utilisés en catalyse, mais dans différentes industries telles que l'[[électronique (technique)|électronique]], la [[galvanoplastie]]. |
||
=== Biochimie === |
=== Biochimie === |
||
[[Fichier:Nickel resin.jpg|vignette|306x306px|Colonne chromatographique en billes de Ni-agarose.]] |
|||
Les billes de nickel agarose sont employées comme matrice ou résine pour effectuer la [[chromatographie d'affinité]] des protéines ou pour leur purification après [[Étiquette poly-histidine|marquage]] en [[biochimie]]. |
Les billes de nickel agarose sont employées comme matrice ou résine pour effectuer la [[chromatographie d'affinité]] des protéines ou pour leur purification après [[Étiquette poly-histidine|marquage]] en [[biochimie]]. |
||
[[Fichier:Nickel resin.jpg|vignette|306x306px|Colonne chromatographique en billes de Ni-agarose]] |
|||
=== Remarques === |
=== Remarques === |
||
Il convient de remarquer que, pour certains usages, le nickel pourrait être remplacé par d'autres éléments exemple : [[platine]] et [[palladium]] pour l'[[hydrogénation]], [[cobalt]] pour les alliages magnétiques ou inoxydables. Le nickel est utilisé principalement en raison de son faible coût d'extraction et de traitement par rapport aux autres solutions techniquement envisageables à ce jour. |
Il convient de remarquer que, pour certains usages, le nickel pourrait être remplacé par d'autres éléments exemple : [[platine]] et [[palladium]] pour l'[[hydrogénation]], [[cobalt]] pour les alliages magnétiques ou inoxydables. Le nickel est utilisé principalement en raison de son faible coût d'extraction et de traitement par rapport aux autres solutions techniquement envisageables à ce jour. |
||
Actuellement dans l'Union |
Actuellement dans l'Union européenne, environ 80 % des produits contenant du nickel arrivés en fin de vie sont collectés et recyclés<ref>{{Lien web|titre = Le nickel dans l'Union européenne|url = http://www.nickelinstitute.org/~/media/Files/MediaCenter/NiInEU/NICKEL_EUROPE_FR_FINAL.ashx|site = Nickel Institute|date = octobre 2012|consulté le = 23/10/2014}}.</ref>. Au niveau mondial, ce sont plus de 50 % du nickel en fin de vie qui est recyclé<ref>{{Lien web|langue = en|titre = Metal Stocks & Recycling Rates|url = http://www.unep.org/pdf/Metals_Recycling_Rates_Summary.pdf|site = UNEP - United Nations Environment Program|consulté le = 23/10/2014}}.</ref>. |
||
== Production et économie |
== Production et économie == |
||
[[Fichier:Nickel world production.svg|vignette|Évolution de la production mondiale de nickel<ref>{{lien web |langue= en |url= http://minerals.usgs.gov/minerals/pubs/historical-statistics/ds140-nicke.pdf |prénom1= T. D. |nom1 =Kelly |prénom2= G. R. |nom2= Matos |titre= Nickel Statistics |éditeur= USGS |lien éditeur=Institut d'études géologiques des États-Unis}}.</ref>.]] |
|||
La bourse de la valeur nickel est située à Londres<ref>[http://www.lme.com/en-gb/metals/non-ferrous/nickel/ london metal exchange]</ref>. Mais la production mondiale reste diverse, selon les pays et les entreprises. |
|||
La bourse de la valeur nickel est située à Londres<ref>[[London Metal Exchange]], [https://www.lme.com/en/Metals/Non-ferrous/LME-Nickel « LME Nickel »].</ref>. La production mondiale reste diverse, selon les pays et les entreprises. |
|||
[[File:Nickel world production.svg|vignette|lang=fr|Évolution de la production mondiale de nickel<ref>{{lien web |langue= en |url= http://minerals.usgs.gov/minerals/pubs/historical-statistics/ds140-nicke.pdf |prénom1= T. D. |nom1 =Kelly |prénom2= G. R. |nom2= Matos |titre= Nickel Statistics |éditeur= U.S. Geological Survey |lien éditeur=United States Geological Survey}}</ref>.]] |
|||
En 2018 (octobre) une étude McKinsey, du CRU et du BRGM a ré-évalué la disponibilité du nickel et d'une cinquantaine d'autres éléments (dans les conditions techniques et économiques du moment, et en tenant mieux compte du besoin de minerai de « qualité », du temps d'épuisement des réserves connues, mais aussi du risque géopolitique et du faible nombre d’acteurs de la chaine d’approvisionnement |
En 2018 (octobre), une étude McKinsey, du CRU et du BRGM, a ré-évalué la disponibilité du nickel et d'une cinquantaine d'autres éléments (dans les conditions techniques et économiques du moment, et en tenant mieux compte du besoin de minerai de « qualité », du temps d'épuisement des réserves connues, mais aussi du risque géopolitique et du faible nombre d’acteurs de la chaine d’approvisionnement{{etc.}}). |
||
Ce travail réalisé dans le cadre du « ''World Materials Forum'' » voulait inciter à réfléchir aux « impacts de l'exploitation de nouvelles matières premières en amont du développement des filières », plutôt qu’aux seuls « critères uniques de prix/performance ». Il conclut qu’un risque de pénurie existe pour des métaux stratégiques moyennement rares : cobalt, nickel, tungstène (demandé par l’aéronautique, le secteur des munitions), l’étain et |
Ce travail réalisé dans le cadre du « ''World Materials Forum'' » voulait inciter à réfléchir aux « impacts de l'exploitation de nouvelles matières premières en amont du développement des filières », plutôt qu’aux seuls « critères uniques de prix/performance ». Il conclut qu’un risque de pénurie existe pour des métaux [[Matières premières stratégiques|stratégiques]] moyennement rares : cobalt, nickel, tungstène (demandé par l’aéronautique, le secteur des munitions), l’étain et trois terres rares nécessaires ou utiles à l’électronique/informatique (dysprosium, néodyme et praséodyme<ref>Novethic (2018), ''[https://www.novethic.fr/actualite/environnement/ressources-naturelles/isr-rse/six-matieres-premieres-essentielles-mettent-la-transition-energetique-en-danger-146027.html Six matières premières essentielles mettent la transition énergétique en danger]'', 4 juillet 2018.</ref>), à la transition énergétique (pour le stockage d'énergie et la mobilité notamment). Pour l’étain, il s’agit de la conséquence croisée de l’épuisement des mines faciles à exploiter et d’un déficit d’exploitation, l’industrie en ayant sous-estimé la demande<ref>[http://www.mediachimie.org/actualite/le-nouveau-tableau-de-mendele%C3%AFev-du-world-materials- ''Le nouveau tableau de Mendeleïev du World Materials Forum''], 29 juin 2018.</ref>. |
||
Le président indonésien [[Joko Widodo]] a réussi à développer une importante activité locale de transformation du nickel. En 2020, l'Indonésie a mis en place un embargo sur l'exportation de minerai brut de nickel, avec pour objectif d'inciter les entreprises étrangères à investir dans des capacités de transformation locale. Les investissements n'ont alors pas tardé à affluer. La Chine a été extrêmement active pour sécuriser son approvisionnement en métaux. Le groupe français Eramet exploite depuis 2020 à Weda Bay la plus grande mine de nickel au monde en partenariat avec le numéro un mondial du nickel, le chinois [[Tsingshan Holding Group|Tsingshan]]. En 2022, l'Indonésie a vu son PIB croître de plus de 5 %<ref>[https://www.lesechos.fr/finance-marches/marches-financiers/comment-lindonesie-est-devenue-en-quelques-annees-un-geant-du-nickel-1936459 Comment l'Indonésie est devenue en quelques années un géant du nickel], [[Les Échos]], 20 avril 2023.</ref>. |
|||
=== Par pays === |
|||
=== Par pays === |
|||
Selon un rapport de GlobalData, la production mondiale de nickel a baissé en 2020 de 7,4 % par rapport à 2019 pour s'établir à {{unité|2195000|[[tonne]]s}} en 2020<ref>https://miningglobal.com/supply-chain-and-operations/global-nickel-production-decline-74-percent-2020</ref>. |
|||
Selon un rapport de GlobalData, la production mondiale de nickel a baissé en 2020 de 7,4 % par rapport à 2019 pour s'établir à {{unité|2195000 tonnes}} en 2020<ref>{{lien web |langue=en |titre=Global nickel production to decline by 7.4 percent in 2020 |url=https://miningglobal.com/supply-chain-and-operations/global-nickel-production-decline-74-percent-2020 |site=miningglobal.com |date=19-10-2020 |consulté le=21-04-2023}}.</ref>. |
|||
Pour l'[[Institut d'études géologiques des États-Unis]], la production mondiale de nickel minier était de {{unité|2500 kt}} en 2020, une baisse de 4 % par rapport à 2019 ({{unité|2610 kt}}), les cinq premiers pays producteurs étant<ref>https://www.kitco.com/news/2021-03-02/World-s-nickel-production-dropped-4-in-2020.html</ref> : |
Pour l'[[Institut d'études géologiques des États-Unis]], la production mondiale de nickel minier était de {{unité|2500 kt}} en 2020, une baisse de 4 % par rapport à 2019 ({{unité|2610 kt}}), les cinq premiers pays producteurs étant<ref>{{lien web |titre=World’s nickel production dropped 4% in 2020 |url=https://www.kitco.com/news/2021-03-02/World-s-nickel-production-dropped-4-in-2020.html |site=Kitco News |date=02-03-2021 |consulté le=21-04-2023}}.</ref> : |
||
* [[Indonésie]] : {{unité|760 kt}} ; |
* [[Indonésie]] : {{unité|760 kt}} ; |
||
* [[Philippines]] : {{unité|320 kt}} ; |
* [[Philippines]] : {{unité|320 kt}} ; |
||
| Ligne 345 : | Ligne 383 : | ||
* [[Australie]] : {{unité|170 kt}}. |
* [[Australie]] : {{unité|170 kt}}. |
||
Les principaux pays producteurs en 2014 sont<ref>{{Lien web|langue=en|titre=World Nickel Producing Countries Map|url=http://www.mapsofworld.com/minerals/world-nickel-producers.html|site= |
Les principaux pays producteurs en 2014 sont<ref>{{Lien web|langue=en|titre=World Nickel Producing Countries Map|url=http://www.mapsofworld.com/minerals/world-nickel-producers.html|site=mapsofworld.com|consulté le=2016-10-14}}.</ref> : |
||
{| class="wikitable" |
{| class="wikitable" |
||
! |
! |
||
!Pays |
!Pays |
||
!Production (t) |
!Production ({{nb|t}}) |
||
!% monde |
!% monde |
||
|- |
|- |
||
|1 |
|1 |
||
|[[Philippines]] |
|[[Philippines]] |
||
|align="right"|{{ |
|align="right"|{{formatnum:440000}} |
||
|align="right"|18,1 |
|align="right"|18,1 |
||
|- |
|- |
||
| Ligne 413 : | Ligne 451 : | ||
|- |
|- |
||
|13 |
|13 |
||
|[[Macédoine du Nord|Macédoine]] |
|[[Macédoine du Nord|Macédoine]]{{exp|*}} |
||
|align="right"|{{unité|21100}} |
|align="right"|{{unité|21100}} |
||
|align="right"|0,9 |
|align="right"|0,9 |
||
|- |
|- |
||
|14 |
|14 |
||
|[[Botswana]] |
|[[Botswana]]{{exp|*}} |
||
|align="right"|{{unité|19600}} |
|align="right"|{{unité|19600}} |
||
|align="right"|0,8 |
|align="right"|0,8 |
||
|- |
|- |
||
|15 |
|15 |
||
|[[Grèce]] |
|[[Grèce]]{{exp|*}} |
||
|align="right"|{{unité|19400}} |
|align="right"|{{unité|19400}} |
||
|align="right"|0,8 |
|align="right"|0,8 |
||
|- |
|- |
||
| colspan="2" |'''Total monde''' |
| colspan="2" |'''Total monde''' |
||
|align="right"|'''{{ |
|align="right"|'''{{formatnum:2430000}}''' |
||
|align="right"|'''100''' |
|align="right"|'''100''' |
||
|} |
|} |
||
{{exp|*}}[http://www.mineralinfo.fr/ ''minéralinfo.fr''], 2013. |
|||
=== Par entreprise === |
=== Par entreprise === |
||
En 2010, les principaux producteurs sont<ref>https://www.bloomberg.com/news/2011-06-07/world-s-10-biggest-refined-nickel-producers-in-2010-table-.html</ref>: |
En 2010, les principaux producteurs sont<ref>https://www.bloomberg.com/news/2011-06-07/world-s-10-biggest-refined-nickel-producers-in-2010-table-.html</ref> : |
||
* [[Norilsk Nickel]] : {{unité|283000| |
* [[Norilsk Nickel]] : {{unité|283000|t}} ; |
||
* [[Vale (entreprise)|Vale]] : {{unité|155000| |
* [[Vale (entreprise)|Vale]] : {{unité|155000|t}} ; |
||
* [[Jinchuan Group]] : {{unité|130000| |
* [[Jinchuan Group]] : {{unité|130000|t}} ; |
||
* [[BHP Billiton]] : {{unité|93000| |
* [[BHP Billiton]] : {{unité|93000|t}} ; |
||
* [[Xstrata]] : {{unité|92000| |
* [[Xstrata]] : {{unité|92000|t}} ; |
||
* [[Sumitomo|Sumitomo Metal Mining]] : {{unité|58000| |
* [[Sumitomo|Sumitomo Metal Mining]] : {{unité|58000|t}} ; |
||
* [[Eramet]] : {{unité|52000| |
* [[Eramet]] : {{unité|52000|t}} ; |
||
* [[Pacific Metals]] : {{unité|40000| |
* [[Pacific Metals]] : {{unité|40000|t}} ; |
||
* [[Anglo American]] : {{unité|38000| |
* [[Anglo American]] : {{unité|38000|t}} ; |
||
* [[Sherritt International]] : {{unité|34000| |
* [[Sherritt International]] : {{unité|34000|t}}. |
||
=== Commerce === |
=== Commerce === |
||
[[Fichier:Electrolytic nickel.jpg|vignette|140x140px|Nickel obtenu par électrolyse d'un tuyau]] |
[[Fichier:Electrolytic nickel.jpg|vignette|140x140px|Nickel obtenu par électrolyse d'un tuyau.]] |
||
[[Fichier:Electrolytic nickel section.jpg|vignette|140x140px|Section de l'accrétion de |
[[Fichier:Electrolytic nickel section.jpg|vignette|140x140px|Section de l'[[accrétion]] de nickel par électrolyse.]] |
||
En 2014, la France est nette importatrice de nickel, d'après les douanes françaises. Le prix moyen à la tonne à l'import était de {{euro|13000}}<ref>{{Lien web|langue = fr | titre = Indicateur des échanges import/export |url =http://lekiosque.finances.gouv.fr/LEO/frame_LEO.asp|site =Direction générale des douanes. Indiquer NC8=26040000 |consulté le = 7 août 2015}}</ref>. |
En 2014, la France est nette importatrice de nickel, d'après les douanes françaises. Le prix moyen à la tonne à l'import était de {{euro|13000}}<ref>{{Lien web|langue = fr | titre = Indicateur des échanges import/export |url =http://lekiosque.finances.gouv.fr/LEO/frame_LEO.asp|site =Direction générale des douanes. Indiquer NC8=26040000 |consulté le = 7 août 2015}}.</ref>. |
||
== Histoire == |
== Histoire == |
||
{{Article détaillé|Histoire de la production du nickel}} |
{{Article détaillé|Histoire de la production du nickel}} |
||
L'utilisation du nickel est très ancienne, attestée jusque {{nobr|3500 {{av JC}}}} Des [[Bronze d'art|bronzes]] trouvés en [[Syrie]] possèdent une teneur en nickel jusqu'à 2 %. D'anciens manuscrits chinois suggèrent que « le cuivre blanc » était utilisé en [[Chine]] entre le {{-sp|XVIII|et le|XV}} |
L'utilisation du nickel est très ancienne, attestée jusque {{nobr|3500 {{av JC}}}} Des [[Bronze d'art|bronzes]] trouvés en [[Syrie]] possèdent une teneur en nickel jusqu'à 2 %. D'anciens manuscrits chinois suggèrent que « le cuivre blanc » était utilisé en [[Chine]] entre le {{-sp|XVIII|et le|XV}} Toutefois, compte tenu du fait que le minerai de nickel était souvent confondu avec celui d'[[argent]], sa connaissance et ses usages ne seront développés que bien plus tard. |
||
Les premières pièces connues de cupronickel blanc-argent, contenant environ 20 % de nickel, ont été frappées |
Les premières pièces connues de cupronickel blanc-argent, contenant environ 20 % de nickel, ont été frappées en [[Bactriane]] pendant le règne d'{{nobr romains|Euthydemus II}}, d'Agathocles et de Pantaleon, aux environs de {{nobr|190 {{av JC}}}}<ref>{{Ouvrage|langue=es|auteur1=Miguel Calvo Rebollar|titre=Construyendo la Tabla Periódica|lieu=Zaragoza, Espagne|éditeur=Prames|année=2019|pages totales=407|passage=115|isbn=978-84-8321-908-9}}.</ref> |
||
La [[niccolite]], minerai de nickel, était très appréciée pour sa capacité à colorer le [[verre]] en vert. |
La [[niccolite]], minerai de nickel, était très appréciée pour sa capacité à colorer le [[verre]] en vert. |
||
Le [[nickelage]] est mis au point par le chimiste anglais [[Michael Faraday]] en 1834. La grande résistance à l'oxydation de la couche nickelée justifie l'emploi de cette technique. |
Le [[nickelage]] est mis au point par le chimiste anglais [[Michael Faraday]] en 1834. La grande résistance à l'oxydation de la couche nickelée justifie l'emploi de cette technique. |
||
[[Fichier:Coniston nickel smelter Converter 1918.png|gauche|vignette|Un des convertisseurs type [[Convertisseur Peirce-Smith|Pierce-Smith]] de la fonderie de Coniston, ville aujourd'hui insérée dans le [[Grand Sudbury]]. Il produisait après mai 1913 une [[Matte (métallurgie)|matte]] à 14 % Cu et 41 % Ni coulée en lingots et transportée vers l'usine de raffinage de la {{Lien|trad=Mond Nickel Company|fr=Mond Nickel Company|texte=Mond company}} en Grande-Bretagne, à Clydach, près de [[Swansea]]<ref>{{Lien web|titre=L'avenir de Coniston, histoire du nickel|url=ww.sudburymuseums.ca/index.cfm?app=w_vmuseum&lang=fr&currID=2176&parID=2170|site=sudburymuseums.ca|consulté le=1 mars 2017}}</ref>.]] |
|||
Aux [[États-Unis]], ''nickel'' ou ''nick'', dans le langage populaire désigna d'abord le cent Indien de cupro-nickel, introduit en [[1859]]. En [[1865]], la désignation se transféra à la pièce de trois cents et l'année suivante à la pièce de cinq cents dite ''Shield'' (Armoiries). La première pièce de monnaie de nickel pur est [[suisse]] et date de [[1881]]<ref>{{en}} [http://www.nidi.org/index.cfm/ci_id/160.htm Trends of Nickel in Coins]</ref>. |
|||
[[Fichier:Coniston nickel smelter Converter 1918.png|gauche|vignette|Un des convertisseurs type [[Convertisseur Peirce-Smith|Pierce-Smith]] de la fonderie de Coniston, ville aujourd'hui insérée dans le [[Grand Sudbury]]. Il produisait après mai 1913 une [[Matte (métallurgie)|matte]] à 14 % Cu et 41 % Ni coulée en lingots et transportée vers l'usine de raffinage de la {{Lien|trad=Mond Nickel Company|fr=Mond Nickel Company|texte=Mond company}} en Grande-Bretagne, à [[Clydach (Swansea)|Clydach]], près de [[Swansea]]<ref>{{Lien web|titre=L'avenir de Coniston, histoire du nickel|url=ww.sudburymuseums.ca/index.cfm?app=w_vmuseum&lang=fr&currID=2176&parID=2170|site=sudburymuseums.ca|consulté le=1 mars 2017}}.</ref>.]] |
|||
En [[bijouterie]], le nickel était auparavant utilisé pur. Le journal "L'Avenir des Colonies et de la Marine" du 31 décembre 1884 offrait ainsi à ses abonnés la possibilité d'acquérir "un assortiment varié de bijoux en nickel pur de la [[Nouvelle-Calédonie]], du meilleur goût et du modèle le plus nouveau"<ref>{{Ouvrage|langue=fr|auteur1=Christine Courtis|titre=Après 1878|sous-titre=les souvenirs du capitaine Kanappe|lieu=Nouméa|éditeur=Publications de la Société d'études historiques de la Nouvelle-Calédonie|année=1984|pages totales=122|passage=page 32|isbn=}}</ref>. |
|||
Aux [[États-Unis]], ''nickel'' ou ''nick'', dans le langage populaire désigna d'abord le cent Indien de cupro-nickel, introduit en [[1859]]. En [[1865]], la désignation se transféra à la pièce de trois cents et l'année suivante à la pièce de cinq cents dite ''Shield'' (Armoiries). La première pièce de monnaie de nickel pur est [[suisse]] et date de [[1881]]<ref>{{en}} [http://www.nidi.org/index.cfm/ci_id/160.htm Trends of Nickel in Coins].</ref>. |
|||
Vers 1880, les pièces de monnaies de 5, 10 et 25 centimes de la République Française sont soit en cuivre pur, soit en cupronickel {{fchim|Cu|75 %|Ni|25 %|}}. Le cupronickel est un alliage monétaire allemand à la [[Belle Époque]]. Les alliages {{fchim|Cu||NiZn}} sont des alliages monétaires belges et chiliens. Nommés [[maillechort]]s en France ou "German silver" (argent des Allemands), ils servent à fabriquer des couverts de tables brillants. |
|||
En [[bijouterie]], le nickel était auparavant utilisé pur. Le journal ''L'Avenir des Colonies et de la Marine'' du {{date-|31 décembre 1884}} offrait ainsi à ses abonnés la possibilité d'acquérir {{citation|un assortiment varié de bijoux en nickel pur de la [[Nouvelle-Calédonie]], du meilleur goût et du modèle le plus nouveau}}<ref>{{Ouvrage|langue=fr|auteur1=Christine Courtis|titre=Après 1878|sous-titre=les souvenirs du capitaine Kanappe|lieu=Nouméa|éditeur=Publications de la Société d'études historiques de la Nouvelle-Calédonie|année=1984|pages totales=122|passage=32}}.</ref>. |
|||
Les métallurgistes en quête d'amélioration des propriétés mécaniques et physico-chimiques des produits ferreux s'aperçoivent que, outre sa facilité d'alliage avec de nombreux métaux, le nickel confère une grande résistance à l'acier et au fer. Il incorpore le nickel dans leurs productions de plus en plus sophistiquées via divers [[Ferronickel|ferronickels]] patiemment mis au point. L'acier à 3 % en masse de nickel est très vite utilisé dans les roues de wagons ferroviaires, puisque l'addition minime de Ni fait passer la charge de {{unité|125 kg/m2}} à {{unité|160 kg/m2}}. Les marines nationales emploient les aciers au nickel pour le blindage des navires. Les aciers faiblement alliés sont facilement durcis, par 2 % de nickel et 1 % de nickel. |
|||
Vers 1880, les pièces de monnaie de 5, 10 et 25 centimes de la République française sont soit en cuivre pur, soit en cupronickel {{fchim|Cu|75 %|Ni|25 %}}. Le cupronickel est un alliage monétaire allemand à la [[Belle Époque]]. Les alliages CuNiZn sont des alliages monétaires belges et chiliens. Nommés « [[maillechort]]s » en France ou « German silver » (argent des Allemands), ils servent à fabriquer des couverts de tables brillants. |
|||
[[Ludwig Mond]] découvre le [[nickel carbonyle]], intermédiaire du [[Procédé Mond|procédé de purification du Ni]] qui porte son nom, mis au point en 1890. L'exploitation du gisement canadien de Sudbury, à base de "[[Pyrrhotite|pyrrhotine]]s nickélifères", a permis en grande partie l'essor de la {{Lien|trad=Mond Nickel Company|fr=Mond Nickel Company}}, créée en septembre 1900 et autorisée par la représentation du fils aîné de Ludwig, [[Robert Mond]] en Ontario en octobre suivant. La compagnie Mond a été englobée en 1929 dans l'[[Inco|International Nickel Company]]. |
|||
Les métallurgistes en quête d'amélioration des propriétés mécaniques et physico-chimiques des produits ferreux s'aperçoivent que, outre sa facilité d'alliage avec de nombreux métaux, le nickel confère une grande résistance à l'acier et au fer. Il incorpore le nickel dans leurs productions de plus en plus sophistiquées via divers [[ferronickel]]s patiemment mis au point. L'acier à 3 % en masse de nickel est très vite utilisé dans les roues de wagons ferroviaires, puisque l'addition minime de Ni fait passer la charge de {{unité|125 kg/m2}} à {{unité|160 kg/m2}}. Les marines nationales emploient les aciers au nickel pour le blindage des navires. Les aciers faiblement alliés sont facilement durcis, par 2 % de nickel et 1 % de nickel. |
|||
[[Ludwig Mond]] découvre le [[nickel carbonyle]], intermédiaire du [[Procédé Mond|procédé de purification du Ni]] qui porte son nom, mis au point en 1890. L'exploitation du gisement canadien de Sudbury, à base de « [[Pyrrhotite|pyrrhotines]] nickélifères », a permis en grande partie l'essor de la {{Lien|Mond Nickel Company}}, créée en {{date-|septembre 1900}} et autorisée par la représentation du fils aîné de Ludwig, [[Robert Mond]] en Ontario en octobre suivant. La compagnie Mond a été englobée en 1929 dans l'[[Inco|International Nickel Company]]. |
|||
Le traitement électrochimique s'est aussi développé à la Belle Époque. Les chimistes ou métallurgistes Becquerel, Roseleur, Adams et Pfannhauser mettent au point un traitement à base de sulfate double de nickel et d'ammonium. Ce sont les premières pièces nickelées, aujourd'hui communes dans les appareils usuels. Le nickelage s'impose comme un procédé de galvanoplastie à la mode. Le fourreau des sabres et les objets apparents de la sellerie sont nickelés. Le recouvrement de nickel concerne les objets en laiton ou en fer facilement oxydables, de façon à les utiliser de manière plus durable. Cet effet de longue durée d'usage, allié à une surface propre et brillante, est recherchée autant sur les instruments de chirurgie que sur les galvanos d'imprimerie en cuivre. Les bains de nickelage utilise par exemple {{unité|80|g}} de sulfate double de nickel et d'ammonium pour un litre d'eau, imposant le dépôt par une densité de courant de {{unité|0.3 A/dm2}} à {{unité|0.6 A/dm2}}. |
Le traitement électrochimique s'est aussi développé à la Belle Époque. Les chimistes ou métallurgistes Becquerel, Roseleur, Adams et Pfannhauser mettent au point un traitement à base de sulfate double de nickel et d'ammonium. Ce sont les premières pièces nickelées, aujourd'hui communes dans les appareils usuels. Le nickelage s'impose comme un procédé de galvanoplastie à la mode. Le fourreau des sabres et les objets apparents de la sellerie sont nickelés. Le recouvrement de nickel concerne les objets en laiton ou en fer facilement oxydables, de façon à les utiliser de manière plus durable. Cet effet de longue durée d'usage, allié à une surface propre et brillante, est recherchée autant sur les instruments de chirurgie que sur les galvanos d'imprimerie en cuivre. Les bains de nickelage utilise par exemple {{unité|80|g}} de sulfate double de nickel et d'ammonium pour un litre d'eau, imposant le dépôt par une densité de courant de {{unité|0.3 A/dm2}} à {{unité|0.6 A/dm2}}. |
||
| Ligne 477 : | Ligne 517 : | ||
Dans les années 1920, la confection d'ustensiles de cuisine en employant des alliages de nickel et/ou les procédés de nickelage est commune. |
Dans les années 1920, la confection d'ustensiles de cuisine en employant des alliages de nickel et/ou les procédés de nickelage est commune. |
||
L'incorporation du nickel dans les aciers des blindages lors de la [[Seconde Guerre mondiale]], a entraîné chez les belligérants la restriction de son usage dans les pièces de monnaie. Mais les nations ou puissances militaires prévoyantes avaient en toute conscience envisagé cette récupération après thésaurisation. |
L'incorporation du nickel dans les aciers des blindages, lors de la [[Seconde Guerre mondiale]], a entraîné chez les belligérants la restriction de son usage dans les pièces de monnaie. Mais les nations ou puissances militaires prévoyantes avaient en toute conscience envisagé cette récupération après [[thésaurisation]]. |
||
== Toxicité == |
== Toxicité == |
||
| Ligne 486 : | Ligne 526 : | ||
Certains composés de nickel sont des corps dangereux ou très toxiques, par exemple le nickel tétra-carbonyle, cancérigène reconnu, présent dans les vapeurs ou fumées. Même la poussière de nickel ou les diverses poudres de nickel finement divisés, utilisé en catalyse, sont également reconnues cancérigènes, ils provoquent d'abord par contact et à faibles doses chroniques des dermites et des allergies cutanées. |
Certains composés de nickel sont des corps dangereux ou très toxiques, par exemple le nickel tétra-carbonyle, cancérigène reconnu, présent dans les vapeurs ou fumées. Même la poussière de nickel ou les diverses poudres de nickel finement divisés, utilisé en catalyse, sont également reconnues cancérigènes, ils provoquent d'abord par contact et à faibles doses chroniques des dermites et des allergies cutanées. |
||
La présence conséquente de nickel d'origine naturelle est toxique : c'est le cas sur les sols ultramafiques. Les sols contaminés massivement par le nickel deviennent stériles et la végétation rare, mises à part quelques rares espèces végétales à grande résistance. Il existe ainsi des plantes hyper-accumulatrices, comme l'[[Alyssum]] murale, qui peut récupérer à la terre souillée {{unité|120 |
La présence conséquente de nickel d'origine naturelle est toxique : c'est le cas sur les sols ultramafiques. Les sols contaminés massivement par le nickel deviennent stériles et la végétation rare, mises à part quelques rares espèces végétales à grande résistance. Il existe ainsi des plantes hyper-accumulatrices, comme l'[[Alyssum]] murale, qui peut récupérer à la terre souillée {{unité|120 kg/ha}}<ref>[http://www.nancy.inra.fr/Toutes-les-actualites/Des-plantes-pour-l-extraction-des-metaux « Des plantes pour extraire des métaux »], INRA Nancy.</ref>. |
||
=== Imprégnation des populations humaines === |
=== Imprégnation des populations humaines === |
||
Elle est ''a priori'' plus élevée dans les régions industrielles minières respectivement concernées par l'extraction et le travail de ce métal |
Elle est ''a priori'' plus élevée dans les régions industrielles minières respectivement concernées par l'extraction et le travail de ce métal. |
||
En |
En 2018 en France, le « ''Volet [[périnatal]]'' » du ''programme national de [[biosurveillance]]'' a publié une évaluation de l'imprégnation des [[femme enceinte|femmes enceintes]] dont pour le nickel (et douze autres métaux ou métalloïdes ainsi que quelques polluants organiques). |
||
Le dosage du nickel a été fait dans les urines de {{ |
Le dosage du nickel a été fait dans les urines de {{nobr|990 femmes}} enceintes au moment de leur arrivée à la maternité. Elles faisaient toutes partie de la « ''[[cohorte épidémiologique|Cohorte]] Elfe'' », un pannel ne comprenant que des femmes ayant accouché en France en 2011 hors [[Corse]] et [[Territoire d'outre-mer (France)|TOM]])<ref name=EtudeF2011>[https://www.actu-environnement.com/media/pdf/news-30352-rapport-polluants-femme-enceinte-2.pdf Métaux et métalloïde] {{pdf}} des recherches de la cohorte Elfe, décembre 2016, [[Santé publique France]] / Imprégnation des femmes enceintes par les polluants de l’environnement en France en 2011. Volet périnatal du programme national de biosurveillance, 224{{nb p.}}, aussi disponible sur ''santepubliquefrance.fr''.</ref>. |
||
Le [[dosage urinaire]] de ces {{ |
Le [[dosage urinaire]] de ces {{nobr|990 femmes}} a donné une [[moyenne géométrique]] de {{nb|1,38 μg}} de nickel par litre d'urine<ref name=EtudeF2011/> ({{nb|1,89 μg/g}} de [[créatinine]])<ref name=EtudeF2011/>. Ces taux sont tels (voire légèrement moindres) que ceux précédemment décrits en France et à l’étranger chez les femmes enceintes ou chez les femmes adultes. Ici l'imprégnation par le nickel augmentait {{Citation|avec le [[tabagisme]] et la consommation de [[thé]]}}. Un lien avec le [[bilan martial]] pourrait éventuellement expliquer cette association avec le thé, mais faute de données {{Citation|sur le statut ferrique des femmes enceintes au sein de la cohorte Elfe ceci reste une hypothèse}}<ref name=EtudeF2011/>. |
||
=== Toxicité pour l'homme === |
=== Toxicité pour l'homme === |
||
Le corps humain contiendrait moins de 500 |
Le corps humain contiendrait moins de {{nb|500 µg}} de nickel. Cet oligo-élément semble très sélectif, il joue un rôle au niveau pulmonaire. Mais sa présence excessive est nocive. |
||
Le [[Centre international de recherche sur le cancer]] classe le nickel dans les substances possiblement [[cancérigène]]s pour l’homme. L'exposition chronique au nickel est un facteur de risque du [[cancer du poumon]]<ref>http://www.lenntech.fr/francais/data-perio/ni.htm</ref>, inscrit à ce titre dans les tableaux de maladies professionnelles. |
Le [[Centre international de recherche sur le cancer]] classe le nickel dans les substances possiblement [[cancérigène]]s pour l’homme. L'exposition chronique au nickel est un facteur de risque du [[cancer du poumon]]<ref>http://www.lenntech.fr/francais/data-perio/ni.htm</ref>, inscrit à ce titre dans les tableaux de maladies professionnelles. |
||
| Ligne 511 : | Ligne 551 : | ||
=== Contamination environnementale === |
=== Contamination environnementale === |
||
Dans le monde, le rejet annuel dans l'atmosphère serait de {{unité|24000 à 87000 t/an}} (selon les évaluations), et il faut y ajouter les {{unité|26000|t}} annuellement émises par les volcans ou issues de l'érosion éolienne<ref name="RNO2001">[http://wwz.ifremer.fr/envlit/content/download/27649/224830/version/1/file/rno01.pdf Surveillance du milieu marin, travaux du Réseau National d'Observation de la Qualité du Milieu Marin Ifremer, le RNO : programmes actuels - L'argent, le cobalt, le nickel et le vanadium dans les mollusques du littoral français - Les carottes sédimentaires, mémoire de la contamination, Bulletin Ifremer, 2002].</ref>. |
|||
Le taux de nickel dans la mer varie selon les lieux du globe ; de {{unité|0.12 |
Le taux de nickel dans la mer varie selon les lieux du globe ; de {{unité|0.12 à 0.70 µg/L}} avec une moyenne de {{unité|0.4 μg/L}}<ref name="RNO2001"/>. |
||
En France, les émissions dans l'air étaient estimées à {{unité|218 t}} en 2002 (pour les sources provenant de la combustion de pétrole et charbon, et de l'industrie métallurgique (métaux non ferreux). L'Agence de l'eau Seine-Normandie a estimé que dans son ''bassin'' une centaine de tonnes de nickel étaient apportées aux cours d'eau, majoritairement à partir du ruissellement agricole V<ref>[http://www.eau-seine-normandie.fr/fileadmin/mediatheque/Expert/Etudes_et_Syntheses/etude_2008/Guide_toxique/Guide_metaux.pdf Recueil de fiches sur les métaux] {{pdf}}, {{p.}}22 (consulté le 29 septembre 2009).</ref>. |
|||
En mer, le taux en est souvent plus élevé près de la côte (de {{unité|4 |
En mer, le taux en est souvent plus élevé près de la côte (de {{unité|4 μg/L}} dans la Seine et de {{unité|1 μg/L}} dans le Rhône, en phase dissoute, et {{unité|50 mg/kg}} par exemple sur les matières en suspension de la Gironde ou environ {{unité|30 mg/kg}} pour la Seine et le Rhône)<ref name="RNO2001"/>. |
||
Aux États-Unis, le Mussel Watch donne un taux moyen dans les [[mytiloida|moules]] de {{unité|1.9 |
Aux États-Unis, le Mussel Watch donne un taux moyen dans les [[mytiloida|moules]] de {{unité|1.9 mg/kg}} (p.s.) avec un maximum de {{unité|3.5 mg/kg}} (p.s.). Pour les huîtres, la moyenne serait de {{unité|1.8 mg/kg}} (p.s.) avec un maximum de {{unité|3.4 mg/kg}} (p.s.). Au nord du territoire [[australie]]n, dans des eaux peu polluées le taux de nickel varie de 0,36 à {{unité|0.44 mg/kg}} (p.s.) pour les huîtres<ref name="RNO2001"/>. |
||
=== Écotoxicité === |
=== Écotoxicité === |
||
Ses effets [[Écotoxicité|écotoxiques]] sont peu étudiés, bien que ce métal présente une forte affinité pour les [[ligand (chimie)|ligands]] organiques comportant une fonction thiol (SH-)<ref name="RNO2001"/>, ce qui explique que sa toxicité est diminuée en présence de ligands<ref name=Custer2016/>. Elle l'est aussi en présence de [[carbone organique dissous]] (COD)<ref name=Custer2016/> et de [[matières en suspension]] (MES)<ref name=Custer2016/> |
Ses effets [[Écotoxicité|écotoxiques]] sont peu étudiés, bien que ce métal présente une forte affinité pour les [[ligand (chimie)|ligands]] organiques comportant une fonction thiol (SH-)<ref name="RNO2001"/>, ce qui explique que sa toxicité est diminuée en présence de ligands<ref name=Custer2016/>. Elle l'est aussi en présence de [[carbone organique dissous]] (COD)<ref name=Custer2016/> et de [[matières en suspension]] (MES)<ref name=Custer2016/> |
||
Son écotoxicité est aussi modulée par le pH du milieu, la présence d'autres métaux ou polluants (qui peuvent avoir des effets synergiques ou non) et selon le mode et la voie d'exposition (nourriture, eau, sédiment), dont chez les [[mollusques aquatiques]]<ref name=Custer2016>Custer, K. W., Hammerschmidt, C. R. |
Son écotoxicité est aussi modulée par le pH du milieu, la présence d'autres métaux ou polluants (qui peuvent avoir des effets synergiques ou non) et selon le mode et la voie d'exposition (nourriture, eau, sédiment), dont chez les [[Malacologie|mollusques aquatiques]]<ref name=Custer2016>Custer, K. W., Hammerschmidt, C. R. et Burton, G. A. (2016), ''{{lang|en|texte=Nickel toxicity to benthic organisms: The role of dissolved organic carbon, suspended solids, and route of exposure, Environmental Pollution}}'', 208, 309-317 ([http://www.sciencedirect.com/science/article/pii/S0269749115300920 résumé]).</ref> qui le bioconcentrent (de 1 à quelques dizaines de mg/kg)<ref name="RNO2001"/>. Chez les [[escargot]]s aquatiques d'eau douce ''[[Hyalella azteca]]'' et ''[[Lymnaea stagnalis]]'', le nickel se montre le moins toxique pour l'animal quand il n'est présent que dans l'eau. Il est plus toxique pour l'escargot dans le sédiment et le plus toxique quand il est présent comme contaminant à la fois dans les trois compartiments (eau, sédiment et nourriture). |
||
Chez l'[[huître]], le développement larvaire est perturbé à {{unité|349|μg/L}} de [[sulfate de nickel(II)|sulfate de nickel]] et à {{unité|891 |
Chez l'[[huître]], le développement larvaire est perturbé à {{unité|349|μg/L}} de [[sulfate de nickel(II)|sulfate de nickel]] et à {{unité|891 μg/L}} chez la [[Moule (mollusque)|moule]] qui y semble donc moins sensible<ref name="RNO2001"/>. Les moules d'eau douce ({{ex}} [[moule zébrée]]) peuvent aussi en accumuler une quantité considérable dans leur coquille. |
||
== Notes et références == |
== Notes et références == |
||
=== Notes === |
|||
{{Références|groupe=Note}} |
|||
=== Références === |
|||
{{Références}} |
{{Références}} |
||
== Bibliographie == |
== Bibliographie == |
||
* Nnamdi Anyadike, ''Nickel. An industry on the brink of expansion'', Woodhead Publishing |
* Nnamdi Anyadike, ''Nickel. An industry on the brink of expansion'', Woodhead Publishing, 2002, 132{{nb p.}} {{ISBN|9781855735941}} (présentation des marchés en 2001). |
||
* Simon Clow, ''The International Nickel Trade'', {{lang|en|texte=International Trade Series}}, Woodhead Publishing |
* Simon Clow, ''The International Nickel Trade'', {{lang|en|texte=International Trade Series}}, Woodhead Publishing, Cambridge (Angleterre), 1992, 140{{nb p.}} {{ISBN|9781855730496}} (industrie du Ni et commerce international en 1990). |
||
* Joseph R. Davis, ''Nickel, cobalt and their alloys'', ASM International |
* Joseph R. Davis, ''Nickel, cobalt and their alloys'', ASM International/Handbook Committee, 2000, 442{{nb p.}} {{ISBN|9780871706850}}. |
||
* Jacques Grilliat (ingénieur [[Conservatoire national des arts et métiers|CNAM]]), Jacques Salbaing (directeur technique et |
* Jacques Grilliat (ingénieur [[Conservatoire national des arts et métiers|CNAM]]), Jacques Salbaing (directeur technique et commercial International Nickel France), Michel Rabinovitch (géologue), Bernard Pire (physicien CNRS), Jacques Gilliat (ingénieur CNAM), article « Nickel », ''[[Encyclopædia Universalis]]'', 2004 (première rédaction avant 1986), [http://www.universalis.fr/encyclopedie/nickel/ début en ligne]. |
||
* Alain Foucault, Jean-François Raoult, Fabrizio Cecca |
* {{mul|fr|en}} Alain Foucault, Jean-François Raoult, Fabrizio Cecca et Bernard Platevoet, ''Dictionnaire de Géologie'', {{8e}}{{éd.}}, édition Dunod, 2014, 416{{nb p.}} Avec la simple entrée « nickel » {{p.|237}}. |
||
* Jean Meunier, |
* Jean Meunier, ''Cobalt et nickel'', {{12e|cahier}} du {{t.}}3, « Métaux » dans Edmond Frémy (dir.), ''Encyclopédie Chimique'', Dunod, Paris, 1889. |
||
* {{Ouvrage |prénom1=Paul |nom1=Pascal |titre=Nouveau traité de chimie minérale |lieu=Paris |éditeur=Masson |année=1956 |réimpression=1966 |format livre=32 vol. |
* {{Ouvrage |prénom1=Paul |nom1=Pascal |titre=Nouveau traité de chimie minérale |lieu=Paris |éditeur=Masson |année=1956 |réimpression=1966 |format livre=32 vol.}}, {{Citation|18. Complexes du fer, du cobalt et du nickel ; 20.1. Alliages métalliques ; 20.2. Alliages métalliques (suite) ; 20.3 Alliages métalliques (suite)}}{{Commentaire biblio|{{BNF|37229023x}}.}} |
||
== Voir aussi == |
== Voir aussi == |
||
{{Autres projets| commons=Category:Nickel| wiktionary=nickel}} |
{{Autres projets| commons=Category:Nickel| wiktionary=nickel}} |
||
| Ligne 547 : | Ligne 590 : | ||
{{colonnes|nombre=3|taille=15| |
{{colonnes|nombre=3|taille=15| |
||
* [[Accumulateur nickel-cadmium]] |
* [[Accumulateur nickel-cadmium]] |
||
* [[Accumulateur nickel-hydrogène]] |
|||
* [[Accumulateur nickel-fer]] |
* [[Accumulateur nickel-fer]] |
||
* [[Accumulateur nickel- |
* [[Accumulateur nickel-hydrogène]] |
||
* [[Accumulateur nickel-hydrure métallique]], [[Accumulateur nickel-hydrure métallique à faible auto-décharge|à faible auto-décharge]] |
|||
* [[Accumulateur nickel-zinc]] |
|||
* [[Chromel]] |
* [[Chromel]] |
||
* [[Couplage de Kumada]] |
* [[Couplage de Kumada]] |
||
* |
* [[Cubaniquel]] (entreprise) |
||
* [[Cupronickel]] |
* [[Cupronickel]] |
||
* Espèces bioaccumulatrices de Ni : [[Dilleniidae]], [[Rinorea niccolifera]], [[Sebertia]], [[ |
* Espèces bioaccumulatrices de Ni : ''[[Dilleniidae]]'', ''[[Rinorea niccolifera]]'', ''[[Sebertia]]'', ''[[Alyssum murale]]'' |
||
* [[Extraction du nickel]] |
* [[Extraction du nickel]] |
||
* [[Ferronickel]] |
* [[Ferronickel]] |
||
| Ligne 572 : | Ligne 616 : | ||
* [[Nigusil]] |
* [[Nigusil]] |
||
* [[Permalloy]] |
* [[Permalloy]] |
||
* Pièces de monnaie : [[Type Semeuse (monnaie)|Franc nickel |
* Pièces de monnaie : [[Type Semeuse (monnaie)|Franc nickel Semeuse]], [[Pièce de 5 francs Hercule (1996)|Cinq francs Hercule]], [[Pièce de 2 euros|{{nobr|2 euros}}]] en cupronickel, [[Pièce britannique décimale de deux livres sterling|Deux livres]] |
||
* [[Procédé Mond]] |
* [[Procédé Mond]] |
||
* |
* Société d'exploitation du nickel [[Vale Inco Nouvelle-Calédonie]], russe [[Nornickel]], chinoise [[Jinchuan Group]] |
||
* [[Synthèse de complexes du nickel]] |
* [[Synthèse de complexes du nickel]] |
||
* [[Société Le Nickel]] |
* [[Société Le Nickel]] |
||
Version du 7 mai 2024 à 13:36
| Nickel | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Nodule de nickel pur (99,9 %), raffiné par électrolyse, à côté d'un cube d'1 cm³ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Position dans le tableau périodique | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Symbole | Ni | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom | Nickel | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro atomique | 28 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe | 10 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Période | 4e période | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bloc | Bloc d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Famille d'éléments | Métal de transition | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [Ar] 3d8 4s2 ou [Ar] 3d9 4s1 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électrons par niveau d’énergie | 2, 8, 16, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques de l'élément | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse atomique | 58,693 4 ± 0,000 2 u[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique (calc) | 135 pm (149 pm) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de covalence | 124 ± 4 pm[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de van der Waals | 163 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| État d’oxydation | 2, 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité (Pauling) | 1,91 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxyde | faiblement basique | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergies d’ionisation[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1re : 7,639 8 eV | 2e : 18,168 84 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3e : 35,19 eV | 4e : 54,9 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5e : 76,06 eV | 6e : 108 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7e : 133 eV | 8e : 162 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 9e : 193 eV | 10e : 224,6 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 11e : 321,0 eV | 12e : 352 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 13e : 384 eV | 14e : 430 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 15e : 464 eV | 16e : 499 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 17e : 571,08 eV | 18e : 607,06 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 19e : 1 541 eV | 20e : 1 648 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 21e : 1 756 eV | 22e : 1 894 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 23e : 2 011 eV | 24e : 2 131 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 25e : 2 295 eV | 26e : 2 399,2 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 27e : 10 288,8 eV | 28e : 10 775,40 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopes les plus stables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques du corps simple | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| État ordinaire | solide (ferromagnétique) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse volumique | 8,902 g·cm-3 (25 °C)[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Système cristallin | Cubique à faces centrées | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté (Mohs) | 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Couleur | Blanc argenté, reflet gris | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 1 455 °C[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d’ébullition | 2 913 °C[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergie de fusion | 17,47 kJ·mol-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergie de vaporisation | 370,4 kJ·mol-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume molaire | 6,59×10-6 m3·mol-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pression de vapeur | 0,545 Pa à 1 456,85 °C |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son | 4 970 m·s-1 à 20 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur massique | 440 J·kg-1·K-1 à 20 °C[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité électrique | 14,3×106 S·m-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 90,7 W·m-1·K-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solubilité | sol. dans HNO3, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Divers | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No ECHA | 100.028.283 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CE | 231-111-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Précautions | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH[7],[8] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| H317, H351, H372, P280 et P314 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SIMDUT[9] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 D2A, D2B, |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704[10] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unités du SI & CNTP, sauf indication contraire. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| modifier |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Le nickel est l'élément chimique de numéro atomique 28, de symbole Ni. Le corps simple nickel est un métal ; à l'état solide, il est ferromagnétique.
Propriétés atomiques
Le nickel est un élément métal de transition du bloc d, le plus léger du groupe 10.
L'atome de nickel possède deux configurations électroniques, [Ar] 3d8 4s2 et [Ar] 3d9 4s1, qui sont très proches en énergie – le symbole [Ar] désigne les électrons du cœur qui ont la configuration de l'atome d'argon. Il existe un désaccord au sujet de la configuration devant être considérée comme étant de plus basse énergie[11]. Les manuels de chimie indiquent la configuration électronique du nickel comme étant [Ar] 4s2 3d8[12], ou bien de façon équivalente comme étant [Ar] 3d8 4s2[13],[14]. Ce choix est en accord avec la règle de Klechkowski, qui prévoit que la sous-couche 4s sera remplie avant la 3d. Il est d'ailleurs appuyé par le fait expérimental que l'état de plus basse énergie de l'atome de nickel est un niveau de la configuration 3d8 4s2, à savoir le niveau 3d8(3F) 4s2 3F, J = 4[15].
Cependant, chacune de ces deux configurations correspond à un ensemble d'états quantiques d'énergies différentes[15]. Les deux ensembles des énergies se recouvrent, et l'énergie moyenne des états de la configuration [Ar] 3d9 4s1 se trouve en fait inférieure à l'énergie moyenne des états de la configuration [Ar] 3d8 4s2.
Pour cette raison, les publications de recherche au sujet des calculs de la structure atomique considèrent que la configuration électronique fondamentale du nickel est [Ar] 3d9 4s1[11].
Généralités, découverte du corps simple et de l'élément

Le nickel est fréquemment associé au cobalt dans les dépôts miniers, il est particulièrement apprécié pour les alliages qu'il forme. Longtemps confondu avec l'argent ou le cuivre, le nickel est aujourd'hui utilisé pour la confection de monnaie et en alliage dans l'industrie.
Le corps simple, métal dense blanc argenté, plus dur et plus tenace que le fer, a été isolé en 1751 à partir d'arséniures de nickel, dénommés de manière générique « Kupfernickel » en allemand, kopparnickel en suédois ou « nickeline » en français, par le chimiste suédois, le baron Axel Frederik von Cronstedt. L'opérateur, ancien élève de Georg Brandt, maître spécialiste des arséniures et découvreur de l'élément cobalt, étudie des résidus verts provenant d'une mine de minerai de cobalt à Helsingland. Est-ce un dernier essai au départ d'extraire du cuivre de ce minerai verdâtre, ce « Kupfernickel » considéré autrefois comme une sorte de « cuivre du diable » puisqu'il en a l'apparence verdâtre et rejeté par les mineurs chevronnés s'ils le détectaient avant l'étape du four ? Il obtient d'abord par chauffage en présence de soufre et de carbonate de potassium de l'oxyde de nickel avant de réduire ce dernier protoxyde de nickel en creuset brasqué avec du charbon actif pour obtenir une poudre qui une fois compactée et mise en lamelle donne un échantillon de métal blanc brillant qu'il appelle trivialement « nickel », pour signifier que cela n'était selon lui nullement du cuivre ou du moins un « faux cuivre »[Note 1]. En observant la chimie différente de ce corps simple, il découvre qu'il s'agit d'un élément chimique.

L'allemand Kupfernickel fait aussi référence à l'action supposée des nains, génies ou gnômes maléfiques des mines, les « nickels du cuivre », sur les veines de cuivre ou de minerais de cuivre, comme d'ailleurs sur les autres veines de minéraux intéressants, par exemple riches en métaux précieux. Selon les auteurs, les nains ou nickels cachaient, subtilisaient ou rendaient invisible la bonne matière évidemment recherchée, comme ils provoquaient malicieusement des tremblements, des bruits ou résonances inquiétantes, des failles perverses où s'infiltraient de l'eau qui ennoyait les galeries ou étaient larguées des vapeurs méphitiques. La dénomination des nains vient de leur patron ou intercesseur médiéval saint Nicolas ou sankt Nickelaas, en latin ecclésiastique Sanctus Nicolaus[Note 2]. Au XIIe siècle, ce saint protecteur des navigateurs, garant de l'équilibre et de la stabilité du monde naturel et des équipements de l'artifice humain, assurait, par sa dévotion et la perpétuation sous son égide des anciennes pratiques ritualisées de mineurs saxons ou germaniques, la tranquillité et la sécurité du milieu minier, comme le calme des flots marins ou fluviaux.
Ces appellations proviennent en partie de l'impossibilité d'extraire le cuivre de ce qu'on croyait à l'époque être apparemment du minerai de cuivre ; on croyait que le « minerai de cuivre » avait subi un mauvais sort de petits démons. En fait, l'erreur rationnelle repose sur ce que les savants naïfs confondaient les minerais de cuivre avec les minerais de nickel, élément chimique qui était tout à fait inconnu, distinct du cuivre.
Le terme nickel est attesté en français écrit vers 1765[16]. L'adjectif nickélifère, déjà attesté en 1818 mais beaucoup plus commun en 1900, qualifie une matière ou un corps contenant du nickel[Note 3]. Le nickelage désigne avant le milieu du XIXe siècle l'action du verbe nickeler, c'est-à-dire couvrir d'une mince couche de nickel, ainsi que le revêtement métallique de nickel protecteur, c'est-à-dire le résultat du verbe nickeler en galvanoplastie[Note 4]. L'adjectif nickelé qualifie un métal ou un alliage recouvert d'une couche de nickel[17]. En 1857, la nickelure désigne une technique particulière, à préciser, par laquelle les métaux peuvent être nickelés et de manière générale, l'art de nickeler et le travail fait par nickelage[18]. Le chimiste Adolphe Wurtz popularise en 1873 l'adjectif nickélique pour qualifier certains composés de nickel[Note 5]. L'alliage NiCr ou nickelchrome est mentionné dans le Grand Larousse encyclopédique en 1932.
Isotopes
Le nickel possède 31 isotopes de nombre de masse variant entre 48 et 78, ainsi que sept isomères nucléaires. Il existe dans la nature sous la forme de cinq isotopes stables ou quasi stables : 58Ni, 60Ni, 61Ni, 62Ni et 64Ni, 58Ni étant le plus abondant (abondance naturelle de 68,077 %[19]). On lui attribue une masse atomique standard de 58,6934(2) u. Vingt-six radioisotopes ont été caractérisés, le plus stable étant 59Ni avec une demi-vie de 76 000 ans, suivi de 63Ni (100,1 ans) et de 56Ni (6 077 j). Tous les autres radioisotopes ont une demi-vie inférieure à 60 h, et la plupart inférieure à 30 s.
Occurrences de l'élément, extraction minière et purification
Le nickel est le 5e élément le plus abondant dans la Terre (2,4 %), mais loin derrière les quatre premiers (fer : 35 %, oxygène : 30 %, silicium : 15 %, magnésium : 13 %)[20]. C'est le 24e dans la croûte terrestre, avec un clarke de 75 à 80 g/t (75–80 ppm) selon les estimations[21], et le 9e dans le manteau avec 1 860 ppm[22]. C'est en revanche un élément majeur du noyau, le 2e (après le fer) dans le noyau interne (environ 20 %) et le 2e ou le 3e dans le noyau externe (environ 5 %).
Le nickel métallique existe à l'état naturel, c'est le nickel natif, qui contient souvent divers autres métaux comme impuretés. Les météorites métalliques, dites météorites de fer, sont constituées d'un alliage fer-nickel (comme le noyau terrestre, et c'est aussi le cas des astéroïdes de type M. Les nodules polymétalliques des profondeurs océaniques sont à base de Mn, Ni, Co, Fe, Cr, etc.


Le nickel se substitue facilement au fer ou au magnésium dans divers silicates de la croûte et du manteau, en particulier ceux des roches magmatiques alcalines ou basiques, voire ultrabasiques comme les péridots et les pyroxènes. Les péridotites peuvent en contenir plus de 3,1 kg/t. Ainsi le nickel apparaît sous forme de silicates ou hydrosilicates, comme les variétés de serpentines comme la garniérite ou nouméite, un silicate complexe de nickel et de magnésium de formule simplifiée (Ni,Mg)3[Si2O5](OH)4 qui peut être aussi considéré comme un composant de roches détritiques ou de latérites[Note 6]. Comme ces derniers assemblages à garniérite sont dénommés minerais saprolithiques, l'adjectif latéritique qualifie souvent les formations plus altérées, à base de limonites nickélifè̠res (Fe, Ni)O(OH). n H2O.
On le trouve sous forme combinée au soufre dans la millérite NiS, la polydymite Ni3S4, la pyrrolite (Fe,Ni)S, la pentlandite (Ni,Fe)9S8 très souvent insérées dans une matrice rocheuse à base de pyrrhotite. Il s'agit de chalcopyrite CuFeS2 ou de pyrrhotite nickélifère des anciens auteurs.
Combiné à l'arsenic ou sous forme d'arséniures ou d'arséniates, il est présent dans la nickéline ou niccolite NiAs de couleur rouge, de chloantite NiAs3, de smaltite, l'annabergite ou « nickel ocre » Ni3(AsO4)2. 8 H2O, d'aerugite, etc.
Il apparaît aussi sous forme d'oxydes, de sulfates, de carbonates, de phosphates, d'antimoniures (breithauptite ou alliage NiSb), de phosphures, de sulfoarséniures (gersdorffite NiAsS ou disomose), etc. Tous ces minéraux sont liés à des gîtes associés à des roches magmatiques, parfois ayant constitués des filons excentrés.
Minerais et extraction minière

Les minerais de nickel sont connus en France au XIXe siècle dans les Pyrénées, les Alpes ou en Algérie. L'extraction du nickel est compliquée par les associations fréquentes avec Fe, Cu, Co, etc. Les minerais sulfurés préalablement oxydés ou grillés étaient réduits par la vapeur d'eau. Pour purifier efficacement le nickel, il faut attendre le procédé Mond qui utilise la formation entre 60 °C et 80 °C du tétracarbonyle de nickel Ni(CO)4 volatil et la pyrolyse de ce corps instable vers 180 °C, laissant un dépôt de nickel métal.
Le nickel est communément présent dans les résidus de la préparation du smalt, à base de sulfoarséniures de nickel parfois dénommé speiss. Le grillage du speiss permet d'obtenir du nickel impur, qui peut être purifié après quelques étapes réitérées d'affinage.
Le nickel, ou plutôt le silicate de magnésie et de nickel préalablement décrit, a longtemps constitué la principale richesse de la Nouvelle-Calédonie, découverte par l'ingénieur Jules Garnier en 1864. Le minerai est exploité à partir d'une teneur supérieure à 0,5 % en masse dans les années 1990. Ce territoire autonome possède environ 30 % des réserves mondiales, estimées alors à plus de 174 millions de tonnes.
Dans les années 1990, les autres pays producteurs sont la Russie, le Canada, l'Australie et Cuba, les États-Unis. Des gisements importants sont exploités en Russie, dans la région de Norilsk. 27 % de la production mondiale de nickel proviennent de mines situées dans le cratère d'impact d'une énorme météorite dite de Sudbury il y a 1,8 milliard d'années[23].
Au début du XXIe siècle, le nickel est extrait de deux types de minerais : les latérites et les sulfures de nickel, ces derniers exploités dans de nombreux gisements dans le monde, en association avec des roches mafiques et ultramafiques. Deux principaux contextes géologiques sont caractérisés :
- les complexes ignés lités, vastes ensembles magmatiques issus du manteau, exploité notamment dans l'Oural (Norilsk), le bouclier canadien (Sudbury), et la province de Gansu en Chine (Jinchuan) ;
- le volcanisme mantellique primitif riche en magnésium de l'Archéen, ou komatiite, formant des gisements par exemple en Australie (Kambalda), au Québec (Raglan) ou au Brésil. Tous ces gisements associent le nickel avec le cuivre, souvent le cobalt et les éléments du groupe du platine. Certains gisements sont associés à des niveaux de shales noirs, notamment à Sotkamo en Finlande.
Mais bien que 70 % des réserves de nickel soient des minerais latéritiques, ceux-ci ne correspondent qu'à 40 % de la production mondiale. Les minerais latéritiques sont essentiellement destinés à la production de ferronickel, les minerais sulfureux, par l'intermédiaire de mattes, étant généralement destinés à la production de nickel très pur[24]. Le grillage des sulfures s'opère au moins entre 500 °C et 700 °C[Note 7]. Les matières fondues subissent ensuite des procédés classiques d'hydrométallurgie.
Qu'ils soient latéritiques ou sulfureux, les minerais de nickel sont exploités dès que leur richesse dépasse 1,3 % de nickel[24]. Cette faible teneur explique la complexité et la diversité des procédés, déterminés par la nature de la gangue du minerai, ainsi que par la qualité du nickel désiré à la fin de l'extraction.
Propriétés physiques et chimiques du corps simple métal, préparation et alliages
Propriétés physiques

Le nickel est un métal blanc argenté, parfois légèrement grisâtre, de densité 8,9. Il existe sous deux variétés allotropiques, le Niα hexagonal instable et le Niβ cubique à faces centrées, variété la plus stable.
Ce corps cristallin de maille cubique est souvent déjà brillant, il possède un bel éclat brillant par polissage. Il fait partie du groupe des métaux non-ferreux[25]. Le nickel est classé comme métal de transition, c'est un corps solide assez dur, le plus dur des métaux après le chrome, tenace, ductile, malléable, en particulier plus malléable que le cobalt. Pour le métallurgiste, les propriétés mécaniques du nickel sont voisines de celles du fer. Il se laisse laminer et étirer en fils assez fins.

Le nickel est bon conducteur de la chaleur et de l'électricité. Il est ferromagnétique aux températures ordinaires[Note 8]. Seuls trois autres éléments possèdent cette propriété : le fer, le cobalt et le gadolinium. Sa température de Curie est de 355 °C, ce qui signifie que le nickel solide est non magnétique (paramagnétique) au-dessus de cette température[26]. En pratique, le champ magnétique s'atténue dès 250 °C..
La maille du nickel β est cubique à faces centrées avec un paramètre cristallin de 0,352 nm, ce qui correspond à un rayon atomique de 0,124 nm. Cette structure cristalline est stable jusqu'aux pressions d'au moins 70 GPa.

Le nickel, comme le cobalt, est plus tenace que le fer. Sa cassure est fibreuse. Métal moins fusible que le fer, mais plus fusible que le chrome, il est facile à travailler. Sa densité apparente peut varier après écrouissage, les pièces montrant une densité apparente passant de 8,3 à 8,8.
Le corps simple est dilatable par la chaleur. La conductivité électrique est 24 % IACS, c'est-à-dire moins du quart que celle du cuivre pur. Il est fusible au-dessus de 1 452 °C et, très pur, bout vers 2 730 °C.
Propriétés chimiques, stabilité de la surface métal et nickelage
Le nickel est stable à l'air et à l'eau. Le nickel ne s'oxyde pas facilement à l'air humide. Le nickel ne s'oxyde pas à l'air froid, l'oxydation existe à l'air très chaud, et d'autant plus importante avec la température croissante. Un fil fin de nickel chauffé brûle dans le gaz oxygène pur. La mousse de nickel, corps poudreux très divisé à haute surface spécifique, peut s'enflammer dans l'air, une fois soumise à un point chaud ou à une étincelle. Le nickel de Raney est un corps pyrophorique.
Le métal nickel pulvérulent est un super-adsorbant de molécules gazeuses, comme l'hydrogène ou le monoxyde de carbone. Il peut retenir et libérer facilement plus de 8 litres de monoxyde de carbone. Les « mousses de nickel », mises au point au cours des années 1980, ont révolutionné la catalyse, notamment en hydrogénation, de même que l'électrochimie.
Le nickel massif est attaqué lentement par les acides non oxydants. Le nickel est facilement dissout dans l'acide sulfurique et l'acide chlorhydrique avec dégagement de gaz hydrogène. La réaction de dissolution peut être conduite dans ces acides dilués ou étendus d'eau.
- Ni solide + 2 H3O+aq ions hydronium en milieu non oxydant + 4 H2O eau → [Ni(H2O)6]2+ cation nickel hydraté vert + H2 gaz
Mis en contact avec l'acide nitrique concentré, la surface du métal devient passive, au même titre que la passivité du fer[Note 9]. En pratique, s'il est attaqué rapidement par l'acide nitrique dilué, le métal Ni est insoluble dans les acides oxydants concentrés. De manière générale, en condition oxydante, l'attaque est lente.

Le nickel est insoluble dans le solvant ammoniac.
Ainsi le métal en plaque ou en revêtement de nickelage pour protéger des métaux oxydables résiste bien à la corrosion et à l'exposition durable à l'air humide, en formant une couche d'oxyde passivante ou protectrice NiO. Il prend souvent une teinte blanc grisâtre.
Le nickel reste le plus souvent intact en solution neutre ou alcaline, en présence d'eau de mer, ou exposé à des conditions atmosphériques clémentes.
Le nickel résiste bien à l'action des bases, même à chaud. Les conditions réductrices retardent de manière générale l'attaque. C'est pourquoi le nickel sert à la manipulation ou au transport d'alcalis concentrés.
Grâce à sa résistance à l'oxydation et à la corrosion, il est utilisé dans les pièces de monnaie, pour le plaquage du fer, du cuivre, du laiton, dans certaines combinaisons chimiques et dans un grand nombre d'alliages.
Préparation du corps simple, production
L'oxyde de nickel était préparé, à partir des arséniures ou sulfo-arséniures de nickel selon les techniques du laboratoire de Georg Brandt, par chauffage avec du soufre S et du carbonate de potasse K2CO3, qui donne de la potasse caustique par chauffage.
La récupération du sulfure de nickel était également possible. Les minerais sont traités par le pentasulfure de potassium K5S5, ce dernier corps étant soluble dans l'eau alors que le sulfure de nickel est insoluble.
Le sulfure de nickel, qui peut aussi être un minerai sulfuré concentré, était ensuite grillé, puis traité par l'acide sulfurique selon un procédé ancien mis au point au laboratoire de Friedrich Wöhler. le soufre part sous la forme de gaz hydrogène sulfuré. Le traitement ultérieur par la potasse donnait un « oxyde de nickel hydraté » ou Ni(OH)2 vert pomme, insoluble.
Au laboratoire, l'oxyde de nickel était ensuite réduit à basse température en tube de verre sous un balayage de gaz hydrogène.
- NiO solide + H2 gaz → Ni métal pulvérulent + H2O vapeur ou liquide évaporé
Les chimistes obtenaient une poudre pulvérulente, réactive et « pyrophorique » puisqu'elle s'enflammait à l'air, une fois mis en contact avec le gaz oxygène composant minoritaire de l'air. L'industrie procédait par une réduction moins coûteuse au charbon, dans un creuset réfractaire, pour obtenir un nickel impur, la poudre métal du commerce contenant les corps simple cobalt, cuivre et fer.
Pour obtenir un nickel purifié, l'oxyde de nickel était traité à l'acide oxalique, et l'oxalate de nickel 2NiO. C4O6 obtenu chauffé au feu de forge en vase clos se décomposait en corps simple Ni et en dioxyde de carbone. Le nickel était réduit dans un creuset fermé adapté, le métal se plaçant au culot.
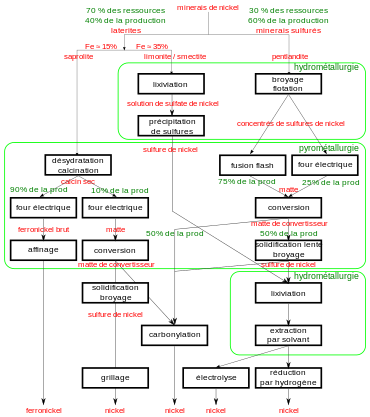
Le principal problème technique était la séparation du nickel du cobalt. Les solutions salines concentrées, préparées avec un oxyde mixte de cobalt et de nickel, étaient neutralisées par la potasse. Au mélange était ajouté en excès une solution de nitrite de potasse, avant qu'il soit mis au repos en milieu acide, par exemple en milieu acide acétique, une journée. Le nitrite double de potassium et de cobalt CoK(NO2)3 avait lentement précipité, et le précipité était récupéré par filtration de la solution, après un lavage soigneux avec une solution aqueuse de chlorure de potassium. Ce corps solide récupéré permettait de fabriquer le jaune de cobalt, utilisé pour la peinture à l'aquarelle. La liqueur filtrée, contant l'ion nickel, était traité à l'hydroxyde de potasse pour précipiter un « oxyde de nickel hydraté » ou hydroxyde de nickel.
Tous les procédés d'extraction actuels combinent encore des techniques d'hydrométallurgie et de pyrométallurgie, dont l'optimisation dépend fortement de la nature du minerai traité. L'activité est éminemment capitalistique : une usine produisant 60 000 t/an de ferronickel à partir de latérite, coûte environ quatre milliards de dollars (Koniambo, Nouvelle-Calédonie), soit un investissement de 70 000 dollars par tonne de nickel produite annuellement. Or en 2010, la tonne de nickel commercialisée sous la forme de ferronickel est cotée 26 000 dollars. Le coût de transformation du minerai en ferronickel se situe à la même époque entre 4 000 et 6 000 dollars pour une usine performante : l'amortissement du capital explique la différence entre prix de vente et coût de production[24].
Le nickel peut être moulu, fondu, mis en forme par moulage. Il est aussi facilement usinable et soudable. Le nickel se soude bien au fer. Autrefois, par laminage de tôles, issues d'un montage composé d'une lame d'acier prise entre deux plaques de nickel, étaient obtenues des tôles plaquées de nickel sur les deux faces.
Alliages à base de nickel
Le nickel peut s'allier en principe avec tous les métaux, sauf avec le plomb, l'argent, le thorium et les métaux alcalins.
Les alliages de Ni les plus courants sont avec les métaux Fe, Mn, Cr, Co, Cu, Zn, Al, etc., et les non-métaux comme le Si[Note 10]. Le nickel renforce notamment la résistance de l'acier à la rupture et à l'attaque chimique.
Les propriétés mécaniques et thermiques des alliages fabriqués sont remarquables, notamment la résistance à l'usure sur de vastes plages de températures, des basses températures à parfois plus de 1 000 °C. Ce sont des matériaux non ou très peu déformables, montrant souvent une quasi-absence de dilatation, une résistance aux réactifs chimiques et à la corrosion atmosphérique, une très faible usure, des propriétés physiques, comme la résistance électrique, peu influencées par le paramètre température.
Le nickel est présent dans un grand nombre d'alliages, des aciers inoxydables et réfractaires à fortes teneurs en chrome et nickel aux fontes de nickel tels que le Ni-resist, des alliages de blindage magnétique, type alliage fer-nickel ou ferro-nickels très durs, sinimax Ni0,43Fe0,54Si0,03 et permalloy aux aimants Alnico, des alliages résistants à la corrosion type hastelloy (par exemple hastelloy C résistant à la corrosion ou hastelloy D à grande résistance mécanique Ni0,84Cu0,03Fe0,02Si0,075Mn0,02Co0,015, parfois au molybdène) ou des nickel-chrome ou chrome-nickel à l'alliage Monel à grande résistance à l'attaque chimique, principalement à base de Ni et Cu, par exemple Ni0,65Cu0,27Fe0,02Si0,03Mn0,03 ou aux divers cupronickels, par exemple pour les pièces de monnaie ou encore le nigusil.
Le nickel est pour le physicien métallurgiste un élément gammagène, c'est-à-dire qui stabilise la phase cubique à faces centrées, et, du coup, favorise l'obtention d'une structure martensitique sur des pièces à grosses sections, en améliorant le résultat de la trempe.

Pour les aciers faiblement alliés, par exemple à base de fer associé à 1,85 % de Ni, 0,8 % de Cr, 0,7 % de Mn, 0,4 % de C, 0,25 % de Mo, le nickel accroît la résistance mécanique, améliore indéniablement les propriétés à basses températures et la résistance à la corrosion. Pour un acier inoxydable austénitique classique, comme le 18/8 (Fe avec 18 % de Cr et 8 % de Ni) ou le 18/10, les métallurgistes s'accordent sur la caractéristique de « surface inoxydable » apportée par le chrome et la résistance mécanique à l'étirement et la résistance à la corrosion, apportées par le nickel. Au niveau des surfaces, il se forme un film d'oxydes protecteurs qui peut annihiler en grande partie les conditions favorables d'oxydation. A contrario, en condition réductrice, et par exemple avec la dissémination de l'ion chlorure responsable de piqûres et de crevasses, la destruction de la couche d'oxydes peut être très rapide sous diverses contraintes, libérant les possibilités d'attaques plus profondes.
La microstructure des aciers spéciaux et super-alliages, observables en partie par les sous-grains et grains, est tributaire de la déformation à chaud de l'acier ou de l'alliage.
On le retrouve dans les « bronzes au nickel » à base de 45 % à 67 % de Cu, de 19 % à 41 % Zn et de 10 % à 26 % Ni, avec des chouïas de Pb entre 0 % et 2,5 %, et 0,5 % de Mn et 0,5 % Fe, les alliages « nickel-bronze-aluminium » à base de Ni, Cu, Zn et Al, le packfong Cu0,5Ni0,25Zn0,25 ou les maillechorts, à base de Cu, Zn et Ni, qui ressemblent peu ou prou au métal argent, mais aussi l'argentan, l'argenton, le ruolz, etc. Des bijoux de faible prix sont ainsi fabriqués en alliage de nickel dit argenté. L'alliage nickel molybdène Ni0,80Mo0,20 est vendu en poudre, ces alliages à partir de Ni0,5Mo0,5 jusqu'à Ni0,875Mo0,125 ont été des modèles précoces pour l'étude de l'oxydation jusqu'à 800 °C[27].
Les propriétés thermiques et électriques justifient les alliages dénommés : invar à 64 % de Fe et 36 % de Ni, constantan (résistance de précision) de formule Cu0,54Ni0,44Mn0,01Fe0,005ZnεSnέ, kovar, platinite, alumel, nimonic NiCrTiCoAl à environ 75 % Ni, cunife, inconel ou incoloy DS, NiCrSi à l'origine des alliages intermétalliques, etc. Le coefficient de dilatation thermique de l'alliage Fe0,53Ni0,29Co0,28 est proche de celui du verre soufflé, il était utilisé comme conducteur dans les ampoules d'éclairage.
Les propriétés magnétiques sont recherchées, par exemple le mu-métal qui tire sa dénomination de sa perméabilité magnétique, l'Alnico des aimants permanents.
Le nickel-chrome est un alliage anti-corrosion et à résistance électrique élevée. L'alliage karma Ni0,74Cr0,20Cu0,03Fe0,03 est un alliage spécifique de jauge de déformation.
Les techniques électrochimiques nous ont laissé d'autres alliages de Ni, comme les zincs alliés. Les procédés de vaporisation thermique (formant des dépôts limités à des couches fines) ou de métallurgie des poudres (en masse plus compacte) permettent de réaliser des alliages WNi, servant de cibles de pulvérisation pour revêtements électrochrome. Les alliages NiTi, comme l'alliage nitinol, sont parmi les premiers reconnus à mémoire de forme. L'alliage nickel-phosphore NiP peut constituer un matériau en réseau ultra-léger tridimensionnel de tubes creux de masse volumique avoisinant 0,9 mg/cm3[28].
Chimie du nickel, corps composés et complexes à base de nickel
Le nickel est moins réactif que le fer et le cobalt, surtout vis à̠ vis des acides et de l'oxygène[Note 11].
À noter la valence 0 du complexe K4[Ni(CN)4] et du composé volatil tétracarbonyle de nickel Ni(CO)4[Note 12].

Son nombre d'oxydation le plus commun est II, il atteste d'un caractère ionique[Note 13].
Il existe les degrés d'oxydation -II, -I, I, III, IV. Le degré d'oxydation III, caractérisé par de nombreux complexes avec des ligands donneurs pour la liaison σ, comme les familles des thiols et des phosphines, est minoritaire, tout comme le degré I, présent dans les alliages avec le sodium, les complexes tétraédriques bien stabilisés, et les enzymes à fonction d'hydrogénation (hydrogénases) et le IV, surtout communément préparé sous forme d'oxyde par les électrochimistes spécialisés dans les cathodes. Plus rares encore sont les degrés d'oxydation -II, -I.

Les sels de nickel sont souvent isomorphes de ceux du fer. Il existe une vaste gamme de sels doubles, diversement hydratés, avec les métaux alcalins et le cation ammonium. Ainsi NiSO4.(NH4)2SO4. 6 H2O… Ils sont très souvent isomorphes des sels doubles où le nickel(II) est remplacé par l'ion fer, cobalt, magnésium, etc., ions métalliques divalents.
Un grand nombre de sel de nickel divalent, une fois dissous dans l'eau, a la couleur vert-pomme de l'ion hydraté [Ni(H2O)6]2+, tout comme les cristaux hydratés de différents sels de nickel. Anhydres, ils sont plutôt jaune ou à nuance de vert plus faible. La couleur dépend toutefois de l'anion, à la fois de son électronégativité et de sa polarisabilité, ainsi NiBr2 est jaune alors que NiI2 est noir. Dissous dans l'ammoniaque, la coloration des solutions est bleue ou violette, grâce aux ions complexes du nickel ammoniacal [Ni(NH3)n]2+.
La chimie du nickel est marquée par les complexes colorés de Ni(II) avec des configurations électroniques suivant la théorie des ligands ou champ de coordination. Leurs structures peuvent être selon l'hybridation :
- dsp2 en plan-carré, à comportement diamagnétique et le plus souvent rouge, brun, jaune, par exemple [Ni(CN)4]2− ;
- sp3 tétraédrique, paramagnétique, le plus souvent bleu ou vert, par exemple [Ni(Cl)4]2− ;
- sp3d2 octaédrique, par exemple [Ni(H2O)6]2+ ou [Ni(NH3)6]2+.
Les complexes de Ni(II) sont difficilement oxydables en complexes de Ni(III), au contraire des ions et complexes de cobalt et de fer[Note 14]. Les complexes de Ni(II) peuvent être facilement réduits en Ni(I) voire en Ni(0). Ainsi le complexe cyanuré [Ni(CN)4]2− peut être réduit en [Ni(CN)3]2−, voire en [Ni(CN)4]4−.
Le cyanure de nickel qui cristallise dans un mélange ammoniac-benzène laisse un cyanure de nickel ammino-benzénique. Tout se passe comme si les molécules de benzène, sans être liées, étaient captées dans les mailles du réseau cristallin formé. Ces complexes sont nommés « clathrates ».
L'ion nickel, comme l'ion vanadium, se retrouve aussi piégé dans les structures supramoléculaires de type porphyrine, par exemple au sein des fractions lourdes de pétrole brut.
Il est possible de fabriquer de la « fonte au nickel » ou du « métal carburé ».
- Ni solide cristal + Ccharbon de bois après chauffage → Ni1-xCx « fonte au nickel » avec x fraction de plusieurs pourcents
L'oxyde de nickel était réduit directement dans un creuset brasqué au feu de forge.
- NiO solide cristal + Ccharbon de bois après chauffage → NiC « métal nickel carburé fondu » + COgaz
Le nickel réagit à chaud avec les corps oxydants, comme le gaz oxygène ou les halogènes, comme le chlore.

Le nickel est chalcophile et arsénophile. Il réagit facilement avec le soufre et l'arsenic.
Principaux composés
Parmi les principaux composés, on peut citer :
- Oxydes de nickel et oxydes mixtes
- Protoxyde ou monoxyde de nickel(II) NiO
- Sesquioxyde de nickel Ni2O3 non basique et instable à la chaleur
- Oxyde magnétique Ni3O4
- Dioxyde de nickel NiO2
- Ferrites au nickel Ni1-xZnxFe2O4
- Oxyhydroxydes de nickel
- Oxyhydroxyde de nickel NiOOH
- Autres oxyhydroxydes de Ni(III) Ni2O3. n H2O
- Autres oxyhydroxydes de Ni(IV) NiO2. n H2O des batteries d'Edison
- Hydroxydes de nickel
- Hydroxyde de nickel Ni(OH)2
- Hydroxyde de nickel hydraté Ni(OH)2. 1⁄4 H2O
- Hydroxyde de nickel III Ni(OH)3
- Fluorures de nickel
- Fluorure de nickel NiF2
- Hexafluoronickélate(IV) de potassium K2[NiF6] instable

- Chlorures de nickel
- Chlorure de nickel divalent NiCl2 jaune
- Hexahydrate de chlorure de nickel NiCl2. 6 H2O aux cristaux vert-émeraude

- Chlorure de nickel hexa-ammonié NiCl2. 6 NH3
- Ammonio-chlorure de nickel NiCl2. NH4Cl. 6 H2O
- Bromures de nickel
- NiBr2, corps brun-jaune déliquescent
- NiBr2. 3 H2O
- NiBr2. 6 NH3, poudre violette

- Bromoplatinate de nickel NiPtBr6. 6 H2O
- Iodures de nickel
- Iodure de nickel NiI2 noir
- Antimoniures de nickel
- NiSb[Note 15]
- Sulfures de nickel
- Sulfure de nickel NiS noir
- Sous-sulfure de nickel Ni3S2
- Sulfure de fer et de nickel
- Arséniures de nickel
- NiAs ou nickéline
- Nickel-skuttérudite, cristal de formule chimique (Ni,Co) As 2 à 3[Note 16]

- Sulfo-antimoniures de nickel
- Sulfo-arséniures de nickel
- Sulfates de nickel

- Sulfate de nickel
- Sulfate de nickel hydraté
- Sulfate double de nickel et d'ammonium hexahydraté NiSO4(NH4)2SO4. 6 H2O
- Nickel-boussingaultite, minéral de formule chimique (NH4)2 (Ni,Mg) (SO4)2, 6 H2O[Note 17]
- Urano-sulfates de nickel
- Nickel-zippeite, minéral de formule chimique Ni2(UO2)6(SO4)3(OH)10,16 H2O[Note 18]
- Carbonates de nickel

- NiCO3
- Hydroxycarbonates x NiCO3 • y Ni(OH)2 • z H2O
- Nitrates de nickel
- Phosphates de nickel

- Borates de nickel
- Borate de nickel(II) Ni(BO2)2[Note 19]
- Sulfamate de nickel
- Chlorates de nickel
- Bromates de nickel
- Arséniates de nickel
- Hydrures de nickel

- Phosphures de nickel
- Cyanures de nickel
- Cyanure de nickel(II) Ni(CN)2
- Complexe de Ni(I) K2[Ni(CN)3] le plus souvent dimérisé
- Complexe de Ni(O) K4[Ni(CN)4]
- Cyanure de nickel ammino-benzénique, « complexe clathrate »
- Glyoximes
- Bis-diméthyl-glyoxime de nickel NiC8H14O4N4, cristaux rouge écarlate, « complexe chélate » insoluble dans l'eau

- Diacétyl-glyoxime de nickel

- Nickel carbonyle ou tétracarbonyle de nickel Ni(CO)4
- Nitroso-carbonyle de nickel Ni(CO)2(NO)2
Il existe aussi des composés organo-nickéliques mieux stabilisés :
- bis(cyclopentadiényl)nickel (II)) ou nickelocène ;
- bis(1,5-cyclooctadiène)nickel.
Analyse
Le nickel colore la perle de borax en jaune pâle à froid, en rouge orange à chaud.
L'analyse quantitative peut utiliser la diméthylglyoxime, ou « réactif de Tschugaeff » : le cation nickel divalent réagit avec la diméthylglyoxime pour donner un composé électriquement neutre, chélate rouge ou écarlate, le bis(diméthylglyoxime) de nickel[Note 20]. Ce complexe important, en analyse qualitative et quantitative du nickel, précipite dans des solutions légèrement ammoniacales.
Utilisations
Le nickel extrait est utilisé pour produire des aciers inoxydables (à hauteur de 68 % du tonnage) des alliages non ferreux (10 %), nickelage électrolytique (9 %), alliages d'acier (7 %), en fonderie (3 %) et enfin pour d'autres usages dont les accumulateurs (4 %)[29]. Environ 27 % de toute la production de nickel est utilisée pour l'ingénierie, 10 % pour la construction, 14 % pour les produits tubulaires, 20 % pour les produits métalliques, 14 % pour le transport, 11 % pour les produits électroniques et 5 % pour d'autres usages[29].
Alliages
Le nickel entre dans la composition de plusieurs familles d'alliages métalliques. En dehors des aciers inoxydables (qui n'appartiennent pas à la famille des alliages de nickel mais à celle des aciers), les alliages de nickel peuvent être classés en trois catégories :
- les alliages fer-nickel : ils sont utilisés pour leurs propriétés physiques, parfois étonnantes. Par exemple, l'invar, alliage fer-nickel contenant 36 % de nickel (FeNi36), est quasiment non dilatable en dessous de 200 °C. Il y est utilisé en cryogénie (cuve des navires méthaniers), en physique des lasers (éléments de structure) ou dans les écrans de téléviseurs cathodiques (shadow mask). Les propriétés physiques des alliages fer-nickel mises à profit sont les propriétés magnétiques (mu-métal, alliages à forte perméabilité magnétique, alliages à bas point de Curie, alliages magnétostrictifs), élastiques (alliages à très faible coefficient thermoélastique), ainsi que leurs extraordinaires propriétés de dilatation (alliages non dilatables ou à dilatation contrôlée) ;
- les alliages cuivre-nickel (cupro-nickels) : ils présentent une très bonne résistance à la corrosion en milieu acide ou marin, ainsi qu'une bonne aptitude à la mise en forme et au soudage ;
- les superalliages : c'est ainsi qu'on appelle une famille d'alliages de composition complexe, à base de nickel (ou de cobalt), comme le nichrome, présentant une excellente résistance à la corrosion sèche à haute température et de très bonnes propriétés mécaniques (limite d'élasticité élevée, résistance au fluage). Ce sont des matériaux de choix pour les turboréacteurs (aéronautique) et certaines chaudières. Le développement de ces alliages a accompagné celui des moteurs d'avion depuis le milieu du XXe siècle. La série des Nimonic, résistante aux fortes pressions et aux hautes températures, sert en particulier à fabriquer des turbines à gaz et des réacteurs.
Le nickel est souvent présent dans les aciers spéciaux. Les aciers au Ni et Cr servent à fabriquer des plaques blindées, des coffres-forts et portes blindées, des chars d'assaut, etc. Le nickel-chrome est utilisé comme résistance chauffante Ni60 à 80 %Cr10 à 25 %FeεMnέ, mais aussi en particulier pour les soins dentaires et comme matériau de soudure[30].

En bijouterie, on associe le nickel à l’or afin d'obtenir une meilleure tenue mécanique ainsi que des couleurs originales. Ainsi, du cuivre, du nickel et de l’or donnent de l’or jaune ou rosé. L’or et le nickel donnent de l’or blanc. Les « bronzes au nickel » se retrouvent dans les profilés pour architecture ou élément de décoration et dans les couverts des services de table, en petite bijouterie avec les alliages alpacca, mais aussi dans les instruments de dessin industriels (compas, pointe sèche…), les mécanismes d'horlogerie comme les ressorts, les pièces de précision de l'instrumentation scientifique et technique, divers composants de mécanique de précision et d'optique.
Autres usages
Le nickelage est le plus souvent un revêtement anti-corrosion, obtenu par placage électrolytique à l'aide de sels hydrosolubles. Il est très utile sur le fer, métal plus sensible à la corrosion.
Un débouché « historique » du nickel sont les pièces de monnaie, où les qualités de malléabilité et de résistance du produit, à faible usure, sont particulièrement appréciées. Ainsi, on trouve du nickel dans les pièces américaines, canadiennes et dans les pièces d'un et de deux euros. Les pièces de nickel pur ou à revêtement de nickel sont blanches, les pièces en cupronickel sont jaunes.
Le nickel sert à fabriquer des aimants, des écrans magnétiques. Il sert à fabriquer des contacteurs électriques et des électrodes, des bougies de moteurs à combustion et explosion. Il est utilisé comme résistance chauffante (grille-pain, radiateur ou encore sèche-cheveux) grâce à son coefficient de conductibilité thermique très faible, ou comme revêtement sur les casques F1 des sapeurs pompiers.
Le nickel sert à fabriquer des spatules, des creusets et divers instruments pour analyse. Des cuves de nickel sont employées pour le transport sur les navires de soude caustique, concentrée ou très pure. Il sert au raffinage et au stockage des solvants chlorés ou de divers composés, comme le phénol. Sa surface propre évite aussi toute contamination ou décoloration de ces matières. Le nickel pur est utilisé pour certains types de cordes de guitare électrique.
Accumulateurs
Le nickel est aussi utilisé dans divers accumulateurs alcalins, type fer-nickel, nickel-cadmium, etc., ou autres. Par exemple, il constitue la cathode des piles alcalines nickel-dioxyde de manganèse, et des accumulateurs alcalins nickel-cadmium, nickel-métal hydrure et nickel-zinc.
Catalyse et photochimie


En dehors de son rôle d'élément d'alliage et de partie d'accumulateurs, le nickel est également utilisé comme catalyseur d'hydrogénation. Les catalyseurs à base de nickel sont utilisés pour hydrogéner les corps gras insaturés, pour fabriquer de la margarine ou certains savons par exemple.
Le nickel de Raney ou le nickel de Sabatier-Senderens catalysent l'hydrogénation. La « mousse de nickel » joue ce rôle.
Certains complexes de Ni(II), comme les thiophénolates alkyl-aminés, jouent un rôle stabilisant vis-à-vis de la lumière, ils sont nommés « désactivateurs » ou « quenchers » en anglais scientifique[Note 21]. Insérés dans les parties chromophores d'un polymère, ces centres jouent un rôle dans le stockage de l'énergie, qui peut être ensuite libérée par la chaleur, la fluorescence et/ou la phosphorescence.
En chimie radicalaire, les complexes de Ni(II) tels que les dialkylthiocarbamates, les thiobisphénolates et autres phosphites, sont des désactivateurs d'hydroxy-peroxydes et des piégeurs efficaces de radicaux libres. Ils peuvent stopper une réaction radicalaire, suffisamment lente.
Ni est un ion actif dans certaines enzymes qui utilisent du nickel comme centre catalytique.
Les sels de nickel (hydroxycarbonate, chlorure, sulfate, hypophosphite, etc.) ne sont seulement utilisés en catalyse, mais dans différentes industries telles que l'électronique, la galvanoplastie.
Biochimie

Les billes de nickel agarose sont employées comme matrice ou résine pour effectuer la chromatographie d'affinité des protéines ou pour leur purification après marquage en biochimie.
Remarques
Il convient de remarquer que, pour certains usages, le nickel pourrait être remplacé par d'autres éléments exemple : platine et palladium pour l'hydrogénation, cobalt pour les alliages magnétiques ou inoxydables. Le nickel est utilisé principalement en raison de son faible coût d'extraction et de traitement par rapport aux autres solutions techniquement envisageables à ce jour.
Actuellement dans l'Union européenne, environ 80 % des produits contenant du nickel arrivés en fin de vie sont collectés et recyclés[31]. Au niveau mondial, ce sont plus de 50 % du nickel en fin de vie qui est recyclé[32].
Production et économie

La bourse de la valeur nickel est située à Londres[34]. La production mondiale reste diverse, selon les pays et les entreprises.
En 2018 (octobre), une étude McKinsey, du CRU et du BRGM, a ré-évalué la disponibilité du nickel et d'une cinquantaine d'autres éléments (dans les conditions techniques et économiques du moment, et en tenant mieux compte du besoin de minerai de « qualité », du temps d'épuisement des réserves connues, mais aussi du risque géopolitique et du faible nombre d’acteurs de la chaine d’approvisionnement, etc.). Ce travail réalisé dans le cadre du « World Materials Forum » voulait inciter à réfléchir aux « impacts de l'exploitation de nouvelles matières premières en amont du développement des filières », plutôt qu’aux seuls « critères uniques de prix/performance ». Il conclut qu’un risque de pénurie existe pour des métaux stratégiques moyennement rares : cobalt, nickel, tungstène (demandé par l’aéronautique, le secteur des munitions), l’étain et trois terres rares nécessaires ou utiles à l’électronique/informatique (dysprosium, néodyme et praséodyme[35]), à la transition énergétique (pour le stockage d'énergie et la mobilité notamment). Pour l’étain, il s’agit de la conséquence croisée de l’épuisement des mines faciles à exploiter et d’un déficit d’exploitation, l’industrie en ayant sous-estimé la demande[36].
Le président indonésien Joko Widodo a réussi à développer une importante activité locale de transformation du nickel. En 2020, l'Indonésie a mis en place un embargo sur l'exportation de minerai brut de nickel, avec pour objectif d'inciter les entreprises étrangères à investir dans des capacités de transformation locale. Les investissements n'ont alors pas tardé à affluer. La Chine a été extrêmement active pour sécuriser son approvisionnement en métaux. Le groupe français Eramet exploite depuis 2020 à Weda Bay la plus grande mine de nickel au monde en partenariat avec le numéro un mondial du nickel, le chinois Tsingshan. En 2022, l'Indonésie a vu son PIB croître de plus de 5 %[37].
Par pays
Selon un rapport de GlobalData, la production mondiale de nickel a baissé en 2020 de 7,4 % par rapport à 2019 pour s'établir à 2 195 000 tonnes en 2020[38].
Pour l'Institut d'études géologiques des États-Unis, la production mondiale de nickel minier était de 2 500 kt en 2020, une baisse de 4 % par rapport à 2019 (2 610 kt), les cinq premiers pays producteurs étant[39] :
- Indonésie : 760 kt ;
- Philippines : 320 kt ;
- Russie : 280 kt ;
- France (Nouvelle-Calédonie) : 200 kt ;
- Australie : 170 kt.
Les principaux pays producteurs en 2014 sont[40] :
| Pays | Production (t) | % monde | |
|---|---|---|---|
| 1 | Philippines | 440 000 | 18,1 |
| 2 | Russie | 260 000 | 10,7 |
| 3 | Indonésie | 244 000 | 10 |
| 4 | Canada | 233 000 | 9,6 |
| 5 | Australie | 220 000 | 9,1 |
| 6 | Nouvelle-Calédonie (France) | 165 000 | 6,8 |
| 7 | Brésil | 126 000 | 5,2 |
| 8 | Chine | 100 000 | 4,1 |
| 9 | Colombie | 75 000 | 3,1 |
| 10 | Cuba | 66 000 | 2,7 |
| 11 | Afrique du Sud | 54 700 | 2,3 |
| 12 | Madagascar | 37 800 | 1,6 |
| 13 | Macédoine* | 21 100 | 0,9 |
| 14 | Botswana* | 19 600 | 0,8 |
| 15 | Grèce* | 19 400 | 0,8 |
| Total monde | 2 430 000 | 100 | |
*minéralinfo.fr, 2013.
Par entreprise
En 2010, les principaux producteurs sont[41] :
- Norilsk Nickel : 283 000 t ;
- Vale : 155 000 t ;
- Jinchuan Group : 130 000 t ;
- BHP Billiton : 93 000 t ;
- Xstrata : 92 000 t ;
- Sumitomo Metal Mining : 58 000 t ;
- Eramet : 52 000 t ;
- Pacific Metals : 40 000 t ;
- Anglo American : 38 000 t ;
- Sherritt International : 34 000 t.
Commerce


En 2014, la France est nette importatrice de nickel, d'après les douanes françaises. Le prix moyen à la tonne à l'import était de 13 000 €[42].
Histoire
L'utilisation du nickel est très ancienne, attestée jusque 3500 av. J.-C. Des bronzes trouvés en Syrie possèdent une teneur en nickel jusqu'à 2 %. D'anciens manuscrits chinois suggèrent que « le cuivre blanc » était utilisé en Chine entre le XVIIIe et le XVe siècle av. J.-C. Toutefois, compte tenu du fait que le minerai de nickel était souvent confondu avec celui d'argent, sa connaissance et ses usages ne seront développés que bien plus tard.
Les premières pièces connues de cupronickel blanc-argent, contenant environ 20 % de nickel, ont été frappées en Bactriane pendant le règne d'Euthydemus II, d'Agathocles et de Pantaleon, aux environs de 190 av. J.-C.[43]
La niccolite, minerai de nickel, était très appréciée pour sa capacité à colorer le verre en vert.
Le nickelage est mis au point par le chimiste anglais Michael Faraday en 1834. La grande résistance à l'oxydation de la couche nickelée justifie l'emploi de cette technique.

Aux États-Unis, nickel ou nick, dans le langage populaire désigna d'abord le cent Indien de cupro-nickel, introduit en 1859. En 1865, la désignation se transféra à la pièce de trois cents et l'année suivante à la pièce de cinq cents dite Shield (Armoiries). La première pièce de monnaie de nickel pur est suisse et date de 1881[45].
En bijouterie, le nickel était auparavant utilisé pur. Le journal L'Avenir des Colonies et de la Marine du offrait ainsi à ses abonnés la possibilité d'acquérir « un assortiment varié de bijoux en nickel pur de la Nouvelle-Calédonie, du meilleur goût et du modèle le plus nouveau »[46].
Vers 1880, les pièces de monnaie de 5, 10 et 25 centimes de la République française sont soit en cuivre pur, soit en cupronickel Cu75 %Ni25 %. Le cupronickel est un alliage monétaire allemand à la Belle Époque. Les alliages CuNiZn sont des alliages monétaires belges et chiliens. Nommés « maillechorts » en France ou « German silver » (argent des Allemands), ils servent à fabriquer des couverts de tables brillants.
Les métallurgistes en quête d'amélioration des propriétés mécaniques et physico-chimiques des produits ferreux s'aperçoivent que, outre sa facilité d'alliage avec de nombreux métaux, le nickel confère une grande résistance à l'acier et au fer. Il incorpore le nickel dans leurs productions de plus en plus sophistiquées via divers ferronickels patiemment mis au point. L'acier à 3 % en masse de nickel est très vite utilisé dans les roues de wagons ferroviaires, puisque l'addition minime de Ni fait passer la charge de 125 kg/m2 à 160 kg/m2. Les marines nationales emploient les aciers au nickel pour le blindage des navires. Les aciers faiblement alliés sont facilement durcis, par 2 % de nickel et 1 % de nickel.
Ludwig Mond découvre le nickel carbonyle, intermédiaire du procédé de purification du Ni qui porte son nom, mis au point en 1890. L'exploitation du gisement canadien de Sudbury, à base de « pyrrhotines nickélifères », a permis en grande partie l'essor de la Mond Nickel Company (en), créée en et autorisée par la représentation du fils aîné de Ludwig, Robert Mond en Ontario en octobre suivant. La compagnie Mond a été englobée en 1929 dans l'International Nickel Company.
Le traitement électrochimique s'est aussi développé à la Belle Époque. Les chimistes ou métallurgistes Becquerel, Roseleur, Adams et Pfannhauser mettent au point un traitement à base de sulfate double de nickel et d'ammonium. Ce sont les premières pièces nickelées, aujourd'hui communes dans les appareils usuels. Le nickelage s'impose comme un procédé de galvanoplastie à la mode. Le fourreau des sabres et les objets apparents de la sellerie sont nickelés. Le recouvrement de nickel concerne les objets en laiton ou en fer facilement oxydables, de façon à les utiliser de manière plus durable. Cet effet de longue durée d'usage, allié à une surface propre et brillante, est recherchée autant sur les instruments de chirurgie que sur les galvanos d'imprimerie en cuivre. Les bains de nickelage utilise par exemple 80 g de sulfate double de nickel et d'ammonium pour un litre d'eau, imposant le dépôt par une densité de courant de 0,3 A/dm2 à 0,6 A/dm2.
Vers 1916, un bain électrochimique a base de chlorure de nickel, sulfate de nickel et acide borique est testé par Watts, qui emploie des adjuvants.
Dans les années 1920, la confection d'ustensiles de cuisine en employant des alliages de nickel et/ou les procédés de nickelage est commune.
L'incorporation du nickel dans les aciers des blindages, lors de la Seconde Guerre mondiale, a entraîné chez les belligérants la restriction de son usage dans les pièces de monnaie. Mais les nations ou puissances militaires prévoyantes avaient en toute conscience envisagé cette récupération après thésaurisation.
Toxicité
En très faible quantité et sous des formes assimilables par l'organisme, le nickel est considéré comme un oligo-élément pour les animaux, également indispensable à la croissance des plantes.
Si le corps simple métal nickel sous forme compacte et massive n'est en principe pas toxique, un contact prolongé avec la peau et les muqueuses peut provoquer des démangeaisons, des prurits et parfois des allergies. L'ingestion de sels solubles dilués dans l'eau provoque nausées, vomissements, diarrhées.
Certains composés de nickel sont des corps dangereux ou très toxiques, par exemple le nickel tétra-carbonyle, cancérigène reconnu, présent dans les vapeurs ou fumées. Même la poussière de nickel ou les diverses poudres de nickel finement divisés, utilisé en catalyse, sont également reconnues cancérigènes, ils provoquent d'abord par contact et à faibles doses chroniques des dermites et des allergies cutanées.
La présence conséquente de nickel d'origine naturelle est toxique : c'est le cas sur les sols ultramafiques. Les sols contaminés massivement par le nickel deviennent stériles et la végétation rare, mises à part quelques rares espèces végétales à grande résistance. Il existe ainsi des plantes hyper-accumulatrices, comme l'Alyssum murale, qui peut récupérer à la terre souillée 120 kg/ha[47].
Imprégnation des populations humaines
Elle est a priori plus élevée dans les régions industrielles minières respectivement concernées par l'extraction et le travail de ce métal.
En 2018 en France, le « Volet périnatal » du programme national de biosurveillance a publié une évaluation de l'imprégnation des femmes enceintes dont pour le nickel (et douze autres métaux ou métalloïdes ainsi que quelques polluants organiques).
Le dosage du nickel a été fait dans les urines de 990 femmes enceintes au moment de leur arrivée à la maternité. Elles faisaient toutes partie de la « Cohorte Elfe », un pannel ne comprenant que des femmes ayant accouché en France en 2011 hors Corse et TOM)[48].
Le dosage urinaire de ces 990 femmes a donné une moyenne géométrique de 1,38 μg de nickel par litre d'urine[48] (1,89 μg/g de créatinine)[48]. Ces taux sont tels (voire légèrement moindres) que ceux précédemment décrits en France et à l’étranger chez les femmes enceintes ou chez les femmes adultes. Ici l'imprégnation par le nickel augmentait « avec le tabagisme et la consommation de thé ». Un lien avec le bilan martial pourrait éventuellement expliquer cette association avec le thé, mais faute de données « sur le statut ferrique des femmes enceintes au sein de la cohorte Elfe ceci reste une hypothèse »[48].
Toxicité pour l'homme
Le corps humain contiendrait moins de 500 µg de nickel. Cet oligo-élément semble très sélectif, il joue un rôle au niveau pulmonaire. Mais sa présence excessive est nocive.
Le Centre international de recherche sur le cancer classe le nickel dans les substances possiblement cancérigènes pour l’homme. L'exposition chronique au nickel est un facteur de risque du cancer du poumon[49], inscrit à ce titre dans les tableaux de maladies professionnelles.
Le nickel est le plus allergisant de tous les métaux. Plus de 12 % de la population y est allergique, dont une majorité de femmes[50]. La réaction la plus fréquente est une dermatite de contact provoquée par un bracelet de montre, des bijoux fantaisie, des accessoires vestimentaires (boucles, boutons, fermetures éclair, etc.).
Malgré cette toxicité, le nickel est resté partie intégrante de la construction des pièces en euros.
Exemple : dans la couronne de la pièce de 2 € ou dans le centre de la pièce de 1 € il y a du nickel, mais se rajoute le cupronickel (alliage de cuivre et nickel) et aussi un alliage avec de plus fortes proportions de cuivre pour les pièces de 1, 2 et 5 centimes d'Euros, ainsi que du cuproaluminium (alliage de cuivre et aluminium)[51].
Il y a des polémiques sur l'utilisation du nickel dans les alliages dentaires non précieux.
Contamination environnementale
Dans le monde, le rejet annuel dans l'atmosphère serait de 24 000 à 87 000 t/an (selon les évaluations), et il faut y ajouter les 26 000 t annuellement émises par les volcans ou issues de l'érosion éolienne[52].
Le taux de nickel dans la mer varie selon les lieux du globe ; de 0,12 à 0,70 µg/L avec une moyenne de 0,4 μg/L[52].
En France, les émissions dans l'air étaient estimées à 218 t en 2002 (pour les sources provenant de la combustion de pétrole et charbon, et de l'industrie métallurgique (métaux non ferreux). L'Agence de l'eau Seine-Normandie a estimé que dans son bassin une centaine de tonnes de nickel étaient apportées aux cours d'eau, majoritairement à partir du ruissellement agricole V[53].
En mer, le taux en est souvent plus élevé près de la côte (de 4 μg/L dans la Seine et de 1 μg/L dans le Rhône, en phase dissoute, et 50 mg/kg par exemple sur les matières en suspension de la Gironde ou environ 30 mg/kg pour la Seine et le Rhône)[52].
Aux États-Unis, le Mussel Watch donne un taux moyen dans les moules de 1,9 mg/kg (p.s.) avec un maximum de 3,5 mg/kg (p.s.). Pour les huîtres, la moyenne serait de 1,8 mg/kg (p.s.) avec un maximum de 3,4 mg/kg (p.s.). Au nord du territoire australien, dans des eaux peu polluées le taux de nickel varie de 0,36 à 0,44 mg/kg (p.s.) pour les huîtres[52].
Écotoxicité
Ses effets écotoxiques sont peu étudiés, bien que ce métal présente une forte affinité pour les ligands organiques comportant une fonction thiol (SH-)[52], ce qui explique que sa toxicité est diminuée en présence de ligands[54]. Elle l'est aussi en présence de carbone organique dissous (COD)[54] et de matières en suspension (MES)[54]
Son écotoxicité est aussi modulée par le pH du milieu, la présence d'autres métaux ou polluants (qui peuvent avoir des effets synergiques ou non) et selon le mode et la voie d'exposition (nourriture, eau, sédiment), dont chez les mollusques aquatiques[54] qui le bioconcentrent (de 1 à quelques dizaines de mg/kg)[52]. Chez les escargots aquatiques d'eau douce Hyalella azteca et Lymnaea stagnalis, le nickel se montre le moins toxique pour l'animal quand il n'est présent que dans l'eau. Il est plus toxique pour l'escargot dans le sédiment et le plus toxique quand il est présent comme contaminant à la fois dans les trois compartiments (eau, sédiment et nourriture).
Chez l'huître, le développement larvaire est perturbé à 349 μg/L de sulfate de nickel et à 891 μg/L chez la moule qui y semble donc moins sensible[52]. Les moules d'eau douce (ex. : moule zébrée) peuvent aussi en accumuler une quantité considérable dans leur coquille.
Notes et références
Notes
- Ce corps simple contient encore des impuretés de Co, Cu, Fe, etc. Pour procéder à une purification, il fallait procéder en solution aqueuse ou avec l'acide oxalique.
- Ces petits êtres de la croyance populaire nordique sont parfois appelés « lutins » par diverses traditions paysannes qui prétendaient les apercevoir en surface, par exemple avec les traces de champignons recycleurs ou autres phénomènes (climatiques…) supposés émanés du sol. En ce sens vague, ils sont très proches des kobolds à l'origine de la dénomination du cobalt. Les jargons des mineurs germaniques semblent toutefois ne pas confondre « nickels » et « cobalts », à moins de les définir catégoriquement en « esprits malins ou petits génies malfaisant, hantant les mines et corrompant à qui-mieux̠-mieux les minerais ». Même dans le folklore, chaque conte fait allusion à un être défini, le « nickel du cuivre » de tel lieu minier précis.
- Il sert ensuite à qualifier un gisement.
- Ce verbe se conjugue à l'instar du verbe appeler, ainsi je nickelle…
- L'adjectif désigne ensuite communément ce qui a rapport au nickel.
- Un nom générique ancien de ces silicates hydratés naturel de Ni, Mg et Ca est nickelgymnite ou gymnite nickélifère. Autrefois les dénominations nouméite et garniérite désignaient respectivement les variétés riches ou pauvres en Ni.
- Cette opération explique le dégagement de dioxyde de soufre SO2.
- Il est pratiquement aussi magnétique que le fer.
- Même remarque pour le nickel avec l'eau régale.
- Dans les années 1980, les alliages les plus importants étaient avec l'acier, le cuivre et l'aluminium.
- En dépit de leur réactivité décroissante, Fe, Co et Ni sont assez semblables d'un point de vue chimique. Le nickel, le palladium et le platine appartiennent au « groupe du nickel », le Pd et le Pt sont nettement moins réactifs que le nickel. Les trois métaux principaux du groupe sont des catalyseurs importants et forment un grand nombre de complexes de coordination.
- La réaction réversible, pivot du procédé Mond qui permet de récupérer et/ou purifier le nickel, est la suivante :
- Ni solide cristal + 4 CO gaz oxyde de carbone, réactif entre 60 °C et 80 °C → Ni(CO)4 gaz qui se décompose vers 180 °C.
- Le nickel divalent est commun et stable, ce qui explique le nombre élevé des composés de Ni(II). L'ion cobalt Co3+ libre est très oxydant, sauf dans certains complexes stables. L'ion ferrique Fe3+ est un oxydant courant, plus modéré.
- [FeII(CN)6]4− peut être oxydé facilement en [FeIII(CN)6]3−.
- Magnetic dependent resistor (MDR).
- Espèce découverte en 1845, classe chimique des sulfures.
- Classe chimique : sulfates, espèce découverte en 1976.
- Espèce minérale découverte en 1976, classe chimique : sulfates.
- Catalyseur.
- Ce composé structuré en cycle est un chélate. La chélation, en particulier par les liaisons hydrogène, stabilise les complexes.
- En référence au verbe to quench, éteindre. Par exemple, le butylaminethiophénolate de Ni(II).
Références
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-420-09084-0)
- (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Transactions, , p. 2832 - 2838 (DOI 10.1039/b801115j)
- John Emsley, The Elements, third edition, Oxford University Press, 1998.
- (en) John H Tundermann, John K. Tien, Timothy E. Howson, Kirk-Othmer encyclopedia of chemical technology 4th ed. : Nickel and Nickel Alloys, vol. 17, John Wiley & Sons.
- (en) Thomas R. Dulski, A manual for the chemical analysis of metals, vol. 25, ASTM International, , 251 p. (ISBN 0803120664, lire en ligne), p. 75
- (en) Metals handbook, vol. 10 : Materials characterization, ASM International, , 1310 p. (ISBN 0-87170-007-7), p. 344
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- SIGMA-ALDRICH
- « Nickel » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- (en) « NICKEL », sur cameochemicals.noaa.gov.
- (en) Scerri, Eric R., The periodic table : its story and its significance, Oxford, Oxford University Press, , 346 p. (ISBN 978-0-19-530573-9 et 0-19-530573-6, lire en ligne), p. 239–240.
- Housecroft C.E. et Sharpe A.G., Chimie inorganique, De Boeck, 2010 (ISBN 978-2-8041-6218-4), p. 19.
- Atkins P.W., Jones L. et Laverman L., Principes de chimie, 3e éd. française, De Boeck, 2014 (ISBN 978-2-8041-8731-6), p. 730.
- Huheey J.E., Keiter E.A. et Keiter A.L., Chimie inorganique, De Boeck 1996 (ISBN 2-8041-2112-7), p. 24.
- NIST Atomic Spectrum Database. Pour lire les niveaux de l'atome de nickel, taper « Ni I » à la boîte « Spectrum » et cliquer sur « Retrieve data ».
- Article de l'Encyclopédie.
- Cet adjectif est dans le Dictionnaire universel rédigé par Louis-Nicolas Bescherelle, en 1845. Le verbe nickeler est cité en 1853 dans le Dictionnaire des arts et manufactures rédigé sous l'autorité de l'ingénieur et fondeur Laboulaye dès 1847.
- Le terme nickelure est présent dans le Journal officiel, en 1875. Plus tard, à la Belle Époque, apparaissent le verbe « nickeliser » et le substantif « nickelisage ».
- (en) « Isotopes of the Element Nickel », Science education, Jefferson Lab.
- (en) James Girard, Principles of Environmental Chemistry, Jones & Bartlett Learning, , 677 p. (ISBN 978-0-7637-2471-9, lire en ligne), p. 9.
- Alain Foucault, op. cit.
- (en) « Element Abundances in the Earth's Mantle » (consulté le ).
- André Brahic, De feu et de glace, éd. Odile Jacob, 2010 (ISBN 978-2-7381-2330-5).
- (en) Frank K. Krundwell, Michael S. Moats, Venkoba Ramachandran, Timothy G. Robinson et William G. Davenport, Extractive Metallurgy of Nickel, Cobalt and Platinum Group Metals, Elsevier, , 610 p. (ISBN 978-0-08-096809-4, lire en ligne), p. 1-15 ; 27-32.
- « Metaux non Ferreux », sur Fédération des entreprises du recyclage (consulté le ).
- Kittel, Charles, Introduction to Solid State Physics, Wiley, (ISBN 0-471-14286-7), p. 449.
- Marie-Josèphe Gouillon, Étude de la cinétique d'oxydation de l'alliage nickel-molybdène (thèse), Génie des procédés, École nationale supérieure des mines de Saint-Étienne, 1974.
- HRL laboratories primé par le Record Guinness, d'après la brève du Monde § 221 du SCF Info en ligne, mars, No 5.
- (en) « Nickel Use In Society » [archive du ], sur Nickel Institute.
- « http://www.atlantic-codental.com/rp2.htm »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ).
- « Le nickel dans l'Union européenne », sur Nickel Institute, (consulté le ).
- (en) « Metal Stocks & Recycling Rates », sur UNEP - United Nations Environment Program (consulté le ).
- (en) T. D. Kelly et G. R. Matos, « Nickel Statistics », USGS.
- London Metal Exchange, « LME Nickel ».
- Novethic (2018), Six matières premières essentielles mettent la transition énergétique en danger, 4 juillet 2018.
- Le nouveau tableau de Mendeleïev du World Materials Forum, 29 juin 2018.
- Comment l'Indonésie est devenue en quelques années un géant du nickel, Les Échos, 20 avril 2023.
- (en) « Global nickel production to decline by 7.4 percent in 2020 », sur miningglobal.com, (consulté le ).
- « World’s nickel production dropped 4% in 2020 », sur Kitco News, (consulté le ).
- (en) « World Nickel Producing Countries Map », sur mapsofworld.com (consulté le ).
- https://www.bloomberg.com/news/2011-06-07/world-s-10-biggest-refined-nickel-producers-in-2010-table-.html
- « Indicateur des échanges import/export », sur Direction générale des douanes. Indiquer NC8=26040000 (consulté le ).
- (es) Miguel Calvo Rebollar, Construyendo la Tabla Periódica, Zaragoza, Espagne, Prames, , 407 p. (ISBN 978-84-8321-908-9), p. 115.
- « L'avenir de Coniston, histoire du nickel », sur sudburymuseums.ca (consulté le ).
- (en) Trends of Nickel in Coins.
- Christine Courtis, Après 1878 : les souvenirs du capitaine Kanappe, Nouméa, Publications de la Société d'études historiques de la Nouvelle-Calédonie, , 122 p., p. 32.
- « Des plantes pour extraire des métaux », INRA Nancy.
- Métaux et métalloïde [PDF] des recherches de la cohorte Elfe, décembre 2016, Santé publique France / Imprégnation des femmes enceintes par les polluants de l’environnement en France en 2011. Volet périnatal du programme national de biosurveillance, 224 p., aussi disponible sur santepubliquefrance.fr.
- http://www.lenntech.fr/francais/data-perio/ni.htm
- http://www.holodent.com/article-13665924.html
- http://www.etna-mint.fr/index.php?page=identifier
- Surveillance du milieu marin, travaux du Réseau National d'Observation de la Qualité du Milieu Marin Ifremer, le RNO : programmes actuels - L'argent, le cobalt, le nickel et le vanadium dans les mollusques du littoral français - Les carottes sédimentaires, mémoire de la contamination, Bulletin Ifremer, 2002.
- Recueil de fiches sur les métaux [PDF], p. 22 (consulté le 29 septembre 2009).
- Custer, K. W., Hammerschmidt, C. R. et Burton, G. A. (2016), Nickel toxicity to benthic organisms: The role of dissolved organic carbon, suspended solids, and route of exposure, Environmental Pollution, 208, 309-317 (résumé).
Bibliographie
- Nnamdi Anyadike, Nickel. An industry on the brink of expansion, Woodhead Publishing, 2002, 132 p. (ISBN 9781855735941) (présentation des marchés en 2001).
- Simon Clow, The International Nickel Trade, International Trade Series, Woodhead Publishing, Cambridge (Angleterre), 1992, 140 p. (ISBN 9781855730496) (industrie du Ni et commerce international en 1990).
- Joseph R. Davis, Nickel, cobalt and their alloys, ASM International/Handbook Committee, 2000, 442 p. (ISBN 9780871706850).
- Jacques Grilliat (ingénieur CNAM), Jacques Salbaing (directeur technique et commercial International Nickel France), Michel Rabinovitch (géologue), Bernard Pire (physicien CNRS), Jacques Gilliat (ingénieur CNAM), article « Nickel », Encyclopædia Universalis, 2004 (première rédaction avant 1986), début en ligne.
- (fr + en) Alain Foucault, Jean-François Raoult, Fabrizio Cecca et Bernard Platevoet, Dictionnaire de Géologie, 8e éd., édition Dunod, 2014, 416 p. Avec la simple entrée « nickel » p. 237.
- Jean Meunier, Cobalt et nickel, 12e cahier du t. 3, « Métaux » dans Edmond Frémy (dir.), Encyclopédie Chimique, Dunod, Paris, 1889.
- Paul Pascal, Nouveau traité de chimie minérale, Paris, Masson, (réimpr. 1966), 32 vol., « 18. Complexes du fer, du cobalt et du nickel ; 20.1. Alliages métalliques ; 20.2. Alliages métalliques (suite) ; 20.3 Alliages métalliques (suite) »
Voir aussi
Articles connexes
- Accumulateur nickel-cadmium
- Accumulateur nickel-fer
- Accumulateur nickel-hydrogène
- Accumulateur nickel-hydrure métallique, à faible auto-décharge
- Accumulateur nickel-zinc
- Chromel
- Couplage de Kumada
- Cubaniquel (entreprise)
- Cupronickel
- Espèces bioaccumulatrices de Ni : Dilleniidae, Rinorea niccolifera, Sebertia, Alyssum murale
- Extraction du nickel
- Ferronickel
- Inco
- Invar, Élinvar
- Isotopes :
- Nichrome
- Nickel (maladie professionnelle), Cancer provoqué par le nickel
- Nickel de Raney
- Nickel de Sabatier
- Nickel natif
- Nickelage, nickelage chimique, nickelage électrolytique
- Nigusil
- Permalloy
- Pièces de monnaie : Franc nickel Semeuse, Cinq francs Hercule, 2 euros en cupronickel, Deux livres
- Procédé Mond
- Société d'exploitation du nickel Vale Inco Nouvelle-Calédonie, russe Nornickel, chinoise Jinchuan Group
- Synthèse de complexes du nickel
- Société Le Nickel
- Tétracarbonyle de nickel
Liens externes
- Images de nickel sous différentes formes
- Le nickel, par l'UDPPC
- Le nickel, par la SCF
- Le Nickel par Henri Moissan et L. Ouvrard, en 1896 ou la même étude en wikisource
- (en) « Technical data for Nickel » (consulté le ), avec en sous-pages les données connues pour chaque isotope
- Propriétés chimiques, et impact du nickel sur la santé et sur l'environnement
- Mini-conférences CEA sur l'origine de la matière, seconde intervention en 20 minutes de Roland Lehoucq sur le nickel après celle d'Étienne Klein
- Usages du nickel par le Groupe Eramet
- (en) Le métal Ni présenté par l'institut du nickel
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||
| Métaux alcalins | Métaux alcalino-terreux | Lanthanides | Métaux de transition | Métaux pauvres | Métalloïdes | Non-métaux | Halogènes | Gaz nobles | Éléments non classés |
| Actinides | |||||||||
| Superactinides |



