« Glace » : différence entre les versions
A bas les FACHOS antiSSectes de wikipédia. Ce sont des CRETINS. ILS NE SAVENT QUE CENSURER CE QUI NE RESSEMBLE PAS ASSEZ A LA PENSEE UNIQUE. CE SONT DES MOUTONS. DE DANGEREUX CRETINS!!!!!!!!!!!!!!!!!! |
m restitution de la dernière modification de Ffx |
||
| Ligne 1 : | Ligne 1 : | ||
La '''glace''' est l'un des trois états naturels de l'[[eau]]. L'eau pure gèle à 0 [[Degré Celsius|°C]]. Les deux autres états sont l'état liquide et l'état gazeux (à 100 °C, la [[vapeur]]). |
|||
=ENQUETES SUR DES FAITS DE DISCRIMINATION PAR L'ADFI= |
|||
Ces deux valeurs sont valables uniquement à [[pression]] [[atmosphère|atmosphérique]] (environ 1,013.10<sup>5</sup> [[pascal|Pa]]). |
|||
Bonjour à toutes et à tous, |
|||
L'une des meilleurs moyens de faire progresser la cause de la liberté de conscience est de collecter et documenter des témoignages de discrimination ou de harcèlement administratif, juridique, social, etc.. |
|||
Nous lançons une ENQUETE sur tout fait de discrimination instigué ou appuyé par l'ADFI/UNADFI, l'une des associations ayant été le plus associée à ces faits. |
|||
Si vous avez subi ou avez été témoins de tels faits, essayez d'obtenir des preuves autant que possible (lettres, minutes de conseil, interviews dans les journaux, bulletins municipaux, etc.) et envoyez-en nous une copie. |
|||
Domaines possibles : |
|||
Enseignement - devoirs, conférences orientées, etc. |
|||
Travail, affaires |
|||
Campagnes de rumeurs |
|||
Education et conflits familiaux |
|||
Droit de manifestations |
|||
Achat/location de locaux |
|||
Liberté thérapeutique |
|||
Discrimination dans la fonction publique |
|||
Pressions sur les librairies pour ne pas vendre certains livres |
|||
Interdiction d'antenne ou de presse / censure |
|||
Exclusion d'un salon |
|||
Dautre part, nous rassemblons une documentation sur toutes les situations où, à la suite d'une action en justice, l'ADFI aurait été condamnée pour diffamation, discrimination, etc. Prière de préciser la juridiction et la date, et tout détail, et la copie du jugement si vous la possédez. |
|||
== Structure cristalline == |
|||
Merci de nous envoyer votre dossier par email à |
|||
contact@coordiap.com, ou par courrier à : CAP, 12 rue Campagne première, 75014 PARIS. |
|||
À pression atmosphérique, les molécules d'eau se structurent de manière tétraédrique, en raison de la liaison hydrogène. De ce fait, les molécules d'eau ne s'empilent pas de manière compacte mais sont espacées, le densité de la glace est donc plus faible que celle de l'eau (environ 0,9) ; le cristal de glace a une structure hexagonale compacte (''a'' = 7,5 [[Mètre|Å]], ''c'' = 7,3 Å). On appelle cette structure la "glace 1h" ou "glace Ih". |
|||
Pour savoir si nous avons déjà votre témoignage ou pour voir des exemples des faits recherchés: |
|||
[www.coordiap.com/temo00.htm témoignages] |
|||
Hors de la Terre, sur d'autres planètes ou des satellites sur lesquels les conditions de pression et de température sont différents, la glace peut adopter d'autres structures plus compactes : glace lc (basse température, cubique à faces centrées, densité env. 0,9), glace II (basse température, orthorhombique centrée, densité env. 1,2), glace III ou Iii (basse température, tétragonal, densité env. 1,1), glace V (haute pression, basse température, monoclinique à base centrée, densité env. 1,2), glace VI (haute pression, basse température, tétragonale, densité env. 1,3), glace VII (haute température, hautee pression, cubique simple, densité env. 1,7), glace VIII (haute pression, tétragonale centré, densité env. 1,6), glace IX (haute pression, tétragonale, densité env. 1,2), glace XII (haute pression, basse température, tétragonale, densité env. 1,3). |
|||
Pour consulter nos actualités et faits récents + notre dernière lettre dinfo : [www.coordiap.com www.coordiap.com] |
|||
On peut représenter la forme cristalline prise par la glace en fonction de la pression et de la température, dans une [[diagramme de phase]]. |
|||
[[Image:diag_phase_glace.png|diagramme de phase de la glace]]<br /> |
|||
<small><em>Diagramme de phase de la glace — l'échelle des pressions est logarithmique</em></small> |
|||
== Fusion eutectique == |
|||
Revenons aux conditions terrestres. En hiver, on sale les routes pour faire fondre la glace. En fait, ce n'est pas la glace qui fond, mais un composé glace-sel, appelé "eutectique". |
|||
Lorsque le sel NaCl (Na<sup>+</sup>, Cl<sup>-</sup>) entre en contact avec la glace,; les ions s'arrangent autour des molécules d'eau, qui sont polaires (H<sub>2</sub><sup>δ+</sup>, O<sup>δ-</sup>) et vient former un composé (H<sub>2</sub>O).(NaCl) ; ce réarrangement nécessite seulement de petits mouvements des atomes, et se fait donc en phase solide. Lorsque les proportions exactes sont respectées (soit environ 77 % de sel en masse), on a un produit qui se conduit comme un produit pur (notamment, il a une température de fusion constant), et qui est qualifié d'« eutectique ». La température de fusion de cet eutectique est d'environ -21 °C. |
|||
Si le taux de sel est inférieur à cette proportion, on a un mélange eau+eutectique, qui fond à une température supérieure (entre -21 et 0 °C). Si le taux de sel est supérieur, on a un mélange sel+eutectique qui fond lui aussi à une température supérieure. On peut tracer un diagramme, dit [[diagramme de phase]], qui représente la température de fusion en fonction des proportion eau-sel. |
|||
[[Image:diag_phase_eau_sel.png|diagramme de phase eau-sel à pression atmosphérique]]<br /> |
|||
<small><em>Diagramme de phase eau-sel à pression atmosphérique ; l'eutectique se forme pour une proportion d'eau de 0,2331 en masse (23,31 % d'eau et 76,69 % de sel en masse)</em></small> |
|||
Le réarrangement eau+sel → eutectique ne peut se faire qu'aux points de contact entre les cristaux de glace et de sel, donc à la surface de la glace. On a donc formation d'une couche superficielle d'eutectique qui fond (si la température est supérieure à -21 °C) ; comme le sel est en sursaturation, il se dissout dans l'eutectique fondu, et peut réagir avec la glace qui se trouve sous la pellicule liquide. Le phénomène se propage donc, jusqu'à ce qu'il manque de l'eau ou du sel pour former un nouvel eutectique. |
|||
En théorie, il serait donc possible de prévenir la formation de glace jusqu'à -21 °C. Dans les faits, il est impossible de doser la quantité de sel à mettre. |
|||
Version du 1 janvier 2004 à 05:38
La glace est l'un des trois états naturels de l'eau. L'eau pure gèle à 0 °C. Les deux autres états sont l'état liquide et l'état gazeux (à 100 °C, la vapeur).
Ces deux valeurs sont valables uniquement à pression atmosphérique (environ 1,013.105 Pa).
Structure cristalline
À pression atmosphérique, les molécules d'eau se structurent de manière tétraédrique, en raison de la liaison hydrogène. De ce fait, les molécules d'eau ne s'empilent pas de manière compacte mais sont espacées, le densité de la glace est donc plus faible que celle de l'eau (environ 0,9) ; le cristal de glace a une structure hexagonale compacte (a = 7,5 Å, c = 7,3 Å). On appelle cette structure la "glace 1h" ou "glace Ih".
Hors de la Terre, sur d'autres planètes ou des satellites sur lesquels les conditions de pression et de température sont différents, la glace peut adopter d'autres structures plus compactes : glace lc (basse température, cubique à faces centrées, densité env. 0,9), glace II (basse température, orthorhombique centrée, densité env. 1,2), glace III ou Iii (basse température, tétragonal, densité env. 1,1), glace V (haute pression, basse température, monoclinique à base centrée, densité env. 1,2), glace VI (haute pression, basse température, tétragonale, densité env. 1,3), glace VII (haute température, hautee pression, cubique simple, densité env. 1,7), glace VIII (haute pression, tétragonale centré, densité env. 1,6), glace IX (haute pression, tétragonale, densité env. 1,2), glace XII (haute pression, basse température, tétragonale, densité env. 1,3).
On peut représenter la forme cristalline prise par la glace en fonction de la pression et de la température, dans une diagramme de phase.

Diagramme de phase de la glace — l'échelle des pressions est logarithmique
Fusion eutectique
Revenons aux conditions terrestres. En hiver, on sale les routes pour faire fondre la glace. En fait, ce n'est pas la glace qui fond, mais un composé glace-sel, appelé "eutectique".
Lorsque le sel NaCl (Na+, Cl-) entre en contact avec la glace,; les ions s'arrangent autour des molécules d'eau, qui sont polaires (H2δ+, Oδ-) et vient former un composé (H2O).(NaCl) ; ce réarrangement nécessite seulement de petits mouvements des atomes, et se fait donc en phase solide. Lorsque les proportions exactes sont respectées (soit environ 77 % de sel en masse), on a un produit qui se conduit comme un produit pur (notamment, il a une température de fusion constant), et qui est qualifié d'« eutectique ». La température de fusion de cet eutectique est d'environ -21 °C.
Si le taux de sel est inférieur à cette proportion, on a un mélange eau+eutectique, qui fond à une température supérieure (entre -21 et 0 °C). Si le taux de sel est supérieur, on a un mélange sel+eutectique qui fond lui aussi à une température supérieure. On peut tracer un diagramme, dit diagramme de phase, qui représente la température de fusion en fonction des proportion eau-sel.
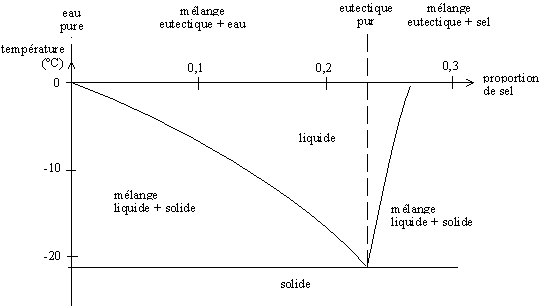
Diagramme de phase eau-sel à pression atmosphérique ; l'eutectique se forme pour une proportion d'eau de 0,2331 en masse (23,31 % d'eau et 76,69 % de sel en masse)
Le réarrangement eau+sel → eutectique ne peut se faire qu'aux points de contact entre les cristaux de glace et de sel, donc à la surface de la glace. On a donc formation d'une couche superficielle d'eutectique qui fond (si la température est supérieure à -21 °C) ; comme le sel est en sursaturation, il se dissout dans l'eutectique fondu, et peut réagir avec la glace qui se trouve sous la pellicule liquide. Le phénomène se propage donc, jusqu'à ce qu'il manque de l'eau ou du sel pour former un nouvel eutectique.
En théorie, il serait donc possible de prévenir la formation de glace jusqu'à -21 °C. Dans les faits, il est impossible de doser la quantité de sel à mettre.
