Autophagie
L’autophagie (du grec αυτο : « soi-même », et φαγειν « manger »), autolyse ou autophagocytose, est un mécanisme physiologique de protection et de recyclage cellulaire mis en place par la cellule. Elle désigne la dégradation d'une partie du cytoplasme par ses propres lysosomes[1]. Ce mécanisme est une source d’énergie et d’acides aminés dans des conditions stressantes pour la cellule, comme l’hypoxie, le manque de nutriments ou l’exposition à des traitements médicamenteux[2],[3].
le terme autophagie regroupe plusieurs voies de dégradation lysosomale des constituants cellulaires dont : la microautophagie, l’autophagie réalisée par des protéines chaperonnes, et la macroautophagie (la forme principale)[4],[5].
La macroautophagie, appelée couramment autophagie, consiste en la capture dans une double membrane lipidique (appelé "autophagosome"), de protéines ou composés cellulaires, et à la dégradation de ses composés après fusion avec un lysosome. C’est la seule voie qui puisse dégrader massivement des macromolécules et des organites. C’est une voie de dégradation alternative à celle du protéasome. En permettant le renouvellement de composants cytoplasmiques endommagés, elle est un mécanisme essentiel pour l’homéostasie cellulaire.
L'histolyse (du grec ἱστος signifiant « tissu ») est le même processus, mais intervenant lors d'une métamorphose, il est utile à l'organisme (par exemple, les amphibiens[6]). L'histolyse est également présente au cours du développement embryonnaire[7].
Yoshinori Ohsumi obtient le prix Nobel de physiologie ou médecine en 2016 pour ses travaux sur l'autophagie.
Historique
La découverte des gènes Atg (autophagy related genes), au milieu des années 1990 chez la levure a été importante, non seulement pour la dissection en termes moléculaires de la macroautophagie, mais aussi pour comprendre son importance en physiologie et physiopathologie. Il existe plus de trente gènes Atg dont plus de la moitié est impliquée dans l’autophagie. Ces gènes sont présents aussi bien dans la levure que dans les cellules de mammifères.
Mode de fonctionnement
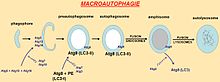
Sur le plan cellulaire, la macroautophagie, la forme principale[8], débute par la formation d’une vacuole qui s’allonge et séquestre de façon non sélective des constituants du cytoplasme. L’autophagosome ainsi formé est délimité par une double membrane phospholipidique. Plusieurs compartiments cellulaires (réticulum endoplasmique, appareil de Golgi et réseau trans-golgien) et la membrane plasmique participeraient probablement à la formation de l’autophagosome. Une quinzaine de protéines Atg sont nécessaires à sa biogenèse. À l’exception d’Atg9, ces protéines ne possèdent pas de domaine transmembranaire. Les protéines Atg, recrutées dans le cytoplasme, se complexent les unes aux autres et s’associent de façon transitoire avec la membrane pré-autophagosomale et à celle de l’autophagosome.
Déclenchement
L’autophagie peut être stimulée en conditions de stress, telles que la carence en nutriments, l’absence de facteurs de croissance ou l’hypoxie. La protéine mTOR (mammalian target of rapamycin) joue un rôle-clé dans l’intégration de ces signaux et la régulation de l’autophagie. Lorsqu’elle est activée, mTor inhibe la voie de l’autophagie, mais son inactivation (à la suite d'une carence en nutriments, par exemple) permet de lever l'inhibition et donc de lancer l’autophagie. Cette enzyme est la cible de la rapamycine (une drogue classiquement utilisée pour induire l’autophagie). Une autre voie déclenchant l'autophagie fait intervenir le complexe Atg6 (aussi appelé Bécline 1)/PI3 kinase de classe III. Ce complexe participe à l’induction de l’autophagie, à l’incurvation du pré-autophagosome et à la formation de l’autophagosome.
Le déroulement ultérieur du processus autophagique repose essentiellement sur deux systèmes de conjugaison analogues aux systèmes d'ubiquitination des protéines :
- le premier conjugué, formé des protéines Atg5-Atg12, permet le recrutement du deuxième complexe sur l'autophagosome en formation, puis est recyclé vers le cytosol.
- le deuxième conjugué résulte de la conjugaison de la protéine Atg8 (MAP-LC3 chez les mammifères) à la phosphatidyléthanolamine (PE) et s’incorpore dans la membrane du pré-autophagosome. LC3 existe donc sous forme cytosolique (LC3-I) ou associé au phagosome (LC3-II = Atg8-PE). LC3-II pourrait jouer une fonction structurale permettant l’élongation et la formation de l’autophagosome mature, et constitue un marqueur cellulaire d'identification des autophagosomes.
Rôles physiologiques
L’autophagie joue un rôle important dans :
- le maintien de l’homéostasie car elle permet l’élimination et le remplacement continuel des protéines et des organites non fonctionnels.
- l’adaptation et la survie des cellules soumises à des conditions de stress.
- l’immunité innée à l’échelle de la cellule car elle permet d’éliminer des pathogènes intracellulaires ;
- l’immunité adaptative car la dégradation des protéines par autophagie génère des peptides qui seront ensuite présentés sur le complexe majeur d'histocompatibilité (CMH).
- Le vieillissement cellulaire. En effet, l'autophagie des mitochondries, appelé mitophagie, permet la recyclage des mitochondries dysfonctionnelles[9] qui génère notamment du stress oxydatif causant des dommages à la cellule. Par ce biais, elle à un rôle protecteur contre le vieillissement cellulaire.
- Le fonctionnement des neurones. ou les mitochondries sont particulièrement actives, et donc ou leur renouvellement joue un rôle essentiel pour empêcher un stress oxydatif trop important[10][11].
Role dans le Cancer
L’identification de molécules impliquées dans le contrôle et l’exécution de l’autophagie a mis en lumière une étroite relation entre l’autophagie et la progression tumorale. Les cellules cancéreuses présentaient généralement une capacité autophagique plus réduite que les cellules normales. Le rôle anti-tumoral de l’autophagie est suggéré par son implication dans la réduction de l’instabilité chromosomique, de la prolifération et de l’inflammation des cellules tumorales. L’autophagie peut aussi être un mécanisme pro-tumoral en permettant la survie des cellules tumorales exposées à des variations de leur micro-environnement (hypoxie, carence nutritionnelle…). Le processus autophagique est induit en réponse à divers traitements anti-cancéreux. Cette réponse peut s'avérer être un mécanisme permettant la survie des cellules, ou favorisant et amplifiant la mort induite par ces traitements.
Role contre les maladies neurodégénératives
Une caractéristique commune à de nombreuses maladies neurodégénératives est l’accumulation de protéines mutées ou toxiques et leur agrégation dans le cytoplasme. Ces maladies sont désignées sous le terme de « protéinopathies » et comprennent notamment la maladie de Huntington, la maladie d’Alzheimer ou la maladie de Machado-Joseph (SCA-3). Ces agrégats de protéines anormales se formeraient, par exemple, à la suite d'une diminution de l’activité du protéasome. Leur présence entraîne une augmentation de cette autophagie induite qui, dans les premiers stades de la maladie, est assez efficace pour assurer leur élimination. Cependant, à un stade plus avancé, l’autophagie induite n’est plus suffisante, et des inclusions protéiques se forment dans les cellules ; la stimulation de l’autophagie (par un agent pharmacologique) pourrait s’avérer efficace pour éliminer ces inclusions et ainsi lutter contre la neurodégénérescence. Dans le cas de la maladie de Machado-Joseph (SCA-3, Spino Cerebellar Ataxia - 3), cette technique de stimulation de l'autophagie est actuellement étudiée par les équipes de Luis Pereira de Almeida, Center for Neurosciences and Cell Biology, University of Coimbra, Largo Marquês de Pombal, 3004-517 Coimbra, Portugal[12].
Notes et références
- (en) NY Lin, C Beyer, A Gießl et al., « Autophagy regulates TNFα-mediated joint destruction in experimental arthritis », Ann. Rheum. Dis., (PMID 22975756, DOI 10.1136/annrheumdis-2012-201671, lire en ligne).
- (en) Michael N. Moore, J. Icarus Allen et Paul J. Somerfield, « Autophagy: Role in surviving environmental stress », Marine Environmental Research, vol. 62, , S420–S425 (DOI 10.1016/j.marenvres.2006.04.055, lire en ligne, consulté le )
- (en) Noboru Mizushima, Akitsugu Yamamoto, Makoto Matsui et Tamotsu Yoshimori, « In Vivo Analysis of Autophagy in Response to Nutrient Starvation Using Transgenic Mice Expressing a Fluorescent Autophagosome Marker », Molecular Biology of the Cell, vol. 15, no 3, , p. 1101–1111 (ISSN 1059-1524 et 1939-4586, PMID 14699058, PMCID PMC363084, DOI 10.1091/mbc.e03-09-0704, lire en ligne, consulté le )
- (en) J Lee, S Giordano et J Zhang, « Autophagy, mitochondria and oxidative stress: cross-talk and redox signalling », Biochem. J., vol. 441, no 2, , p. 523–540 (PMID 22187934, PMCID 3258656, DOI 10.1042/BJ20111451, lire en ligne).
- (en) Mizushima N, Ohsumi Y, Yoshimori T, « Autophagosome formation in mammalian cells », (PMID 12576635), p. 421–429.
- D. L. Stocum, « Amphibian Regeneration and Stem Cells », dans Regeneration: Stem Cells and Beyond, vol. 280, Springer Berlin Heidelberg, (ISBN 978-3-642-62321-9, DOI 10.1007/978-3-642-18846-6_1, lire en ligne), p. 1–70
- (en) F.J. Edwards, « Development and histolysis of the indirect flight muscles in Dysdercus intermedius », Journal of Insect Physiology, vol. 15, no 9, , p. 1591–1599 (DOI 10.1016/0022-1910(69)90179-6, lire en ligne, consulté le )
- (en) B Levine, N Mizushima et HW Virgin, « Autophagy in immunity and inflammation », Nature, vol. 469, no 7330, , p. 323–335 (PMID 21248839, PMCID 3131688, DOI 10.1038/nature09782).
- (en) Sarah Pickles, Pierre Vigié et Richard J. Youle, « Mitophagy and Quality Control Mechanisms in Mitochondrial Maintenance », Current Biology, vol. 28, no 4, , R170–R185 (DOI 10.1016/j.cub.2018.01.004, lire en ligne, consulté le )
- (en) Elayne M. Fivenson, Sofie Lautrup, Nuo Sun et Morten Scheibye-Knudsen, « Mitophagy in neurodegeneration and aging », Neurochemistry International, vol. 109, , p. 202–209 (PMID 28235551, PMCID PMC5565781, DOI 10.1016/j.neuint.2017.02.007, lire en ligne, consulté le )
- (en) H. Chen et D. C. Chan, « Mitochondrial dynamics-fusion, fission, movement, and mitophagy-in neurodegenerative diseases », Human Molecular Genetics, vol. 18, no R2, , R169–R176 (ISSN 0964-6906 et 1460-2083, PMID 19808793, PMCID PMC2758711, DOI 10.1093/hmg/ddp326, lire en ligne, consulté le )
- (en) « Overexpression of the autophagic beclin-1 protein clears mutant ataxin-3 and alleviates Machado–Joseph disease », .
Voir aussi
Articles connexes
Liens externes
- « Club francophone de l'autophagie (CFATG) » (consulté le )
- HADb, une base de données dédiée à l'autophagie
- L'autophagie : un nouveau concept en cancérologie, magazine Bull Cancer, volume 95, no 1, p. 43-50
- L'autophagie remplaçant de luxe du protéasome, magazine Médecine Sciences, volume 24, no 1, p. 19-21
- Les deux visages de l'autophagie dans le système nerveux, magazine Médecine Sciences, volume 25, no 4, p. 383-388
